
【题目】在元素周期表中金属元素与非金属元素的分界线附近的一些元素能用于制( )
A.合金B.半导体C.催化剂D.农药
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于蛋白质在人体内的生理功能的说法中,不正确的是
A. 构成和修补人体组织 B. 构成骨骼的主要成分
C. 构成酶和激素的主要成分 D. 构成抗体的主要成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是混合物分离的实验,请回答有关问题
实验:通过蒸馏的方法除去自来水中含有的氯离子等杂质制取纯净水,如图所示
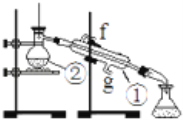
(1)写出下列仪器的名称:①________②________。
(2)若利用以上装置分离酒精和四氯化碳两种溶液的混合物,还缺少的仪器是________,图中装置中进水口是________。(填“f”或“g”)
(3)仪器①中常加入碎瓷片,这样做的目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1molAlN需转移3mol电子
C. AlN中氮元素的化合价为+3
D. CO是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了控制温室效应,各国科学家提出了不少方法和设想。有人根据液态二氧化碳气体的密度大于海水密度的事实,设想将二氧化碳液化后送入深海海底。以减少二氧化碳气体的浓度。为使二氧化碳液化,可采用的方法是
A. 减压、升温 B. 增压、升温 C. 减压、降温 D. 增压、降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法是还原沉淀法。该法的工艺流程为:
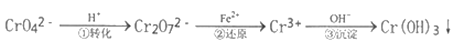
已知:CrO42-(黄色)、Cr2O72- (橙色)
(1)用离子方程式表示第①步可逆反应转化过程___________________。
(2)用离子方程式表示第②步还原反应转化过程___________________。
(3)能说明第①步反应达平衡状态的是_________。
a.Cr2O72-和CrO42-的浓度不变 b.2V(Cr2O72-) =V(CrO42-) c.溶液的颜色不变
(4)第②步中,还原1.5mol Cr2O72-离子,需要_______mol的FeSO47H2O。
(5)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr (OH)3 (s)![]() Cr3+ (aq) +3OH- (aq)。常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-) = 10-32,要使0.01mol/Lc(Cr3+)开始沉淀,溶液的pH应调至__________,若使c(Cr3+)降至10-5mol/L,溶液的pH应调至___________。
Cr3+ (aq) +3OH- (aq)。常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-) = 10-32,要使0.01mol/Lc(Cr3+)开始沉淀,溶液的pH应调至__________,若使c(Cr3+)降至10-5mol/L,溶液的pH应调至___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓硫酸和乙醇制乙烯的装置如图所示,对下列操作或现象描述正确的是( )
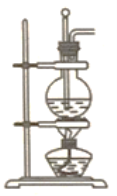
A. 圆底烧瓶中先加浓硫酸再加入乙醇
B. 实验得到的气体能使溴水褪色说明有乙烯生成
C. 反应中圆底烧瓶内会产生黑色固体
D. 用排水法或向下排空气法收集乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列各图曲线表征的信息。得出的结论正确的是
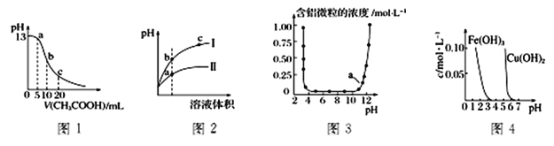
A. 图1表示常温下向体积为10mL0.1 molL-1NaOH溶液中逐滴加入0.1 molL-1CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-)
B. 图2表示用水稀释pH相同的盐酸和NH4C1溶液时。溶液的pH变化曲线,其中Ⅰ表示盐酸,Ⅱ表示NH4C1溶液,且溶液导电性:b>c>a
C. 图3表示的是Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+
D. 由图4得出若除去Fe2(SO4)3溶液中的Cu2+,可采用向溶液中加入适量Fe2O3,调节溶液的pH 至4左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现使用酸碱中和滴定法测定市售白醋的含酸量(g/100 mL)。
Ⅰ、实验步骤:
(1)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪器名称)中定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴________作指示剂。
(3)读取盛装0.1000 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如下图所示,则此时的读数为________mL。
![]()
(4)滴定。当______________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ、实验记录
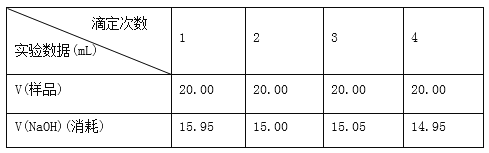
Ⅲ、数据处理与讨论:
(1)按正确数据处理,可得市售白醋含酸量=________g/100 mL(结果保留四位有效数字)。
(2)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子互换反应,需查找在一定温度下的醋酸与苯甲酸的______(填写序号)。
a.pH b.沸点 c.电离常数 d.溶解度
(3)在本实验的滴定过程中,下列操作会使实验结果偏大的是________(填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com