
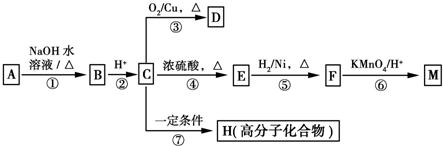
 $→_{H+}^{KMnO_{4}}$
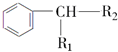
$→_{H+}^{KMnO_{4}}$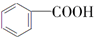 (R1、R2表示烃基或氢原子)
(R1、R2表示烃基或氢原子)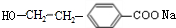 .
. .
. .
.分析 A与F分子中所含碳原子数相同,且均能与 NaHCO3溶液反应,均含有-COOH,F的分子式为C9H10O2,不饱和度为$\frac{2×9+2-10}{2}$=5,且不能使溴的CCl4溶液褪色,不含不饱和键,应含有苯环,F发生氧化反应生成M,M与NaOH溶液反应后的产物,其一氯代物只有一种,故F中应含有乙基,且与羧基处于对位,故F为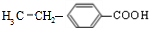 ,M为
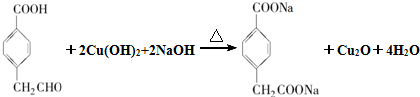
,M为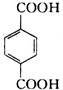 .由A→B→C的转化可知,C中含有-COOH,C发生氧化反应生成D,D能发生银镜反应,结合F的结构可知,C为
.由A→B→C的转化可知,C中含有-COOH,C发生氧化反应生成D,D能发生银镜反应,结合F的结构可知,C为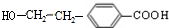 ,故D为
,故D为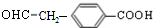 ,B为
,B为 ,A的相对分子质量在180〜260之间,故A中苯环上的乙基中不可能连接羟基,应为卤素原子,A的结构为
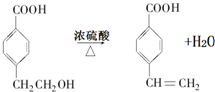
,A的相对分子质量在180〜260之间,故A中苯环上的乙基中不可能连接羟基,应为卤素原子,A的结构为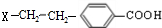 ,X相对原子质量大于180-28-76-45=31,小于260-28-76=111,X可能为Cl或Br.C发生消去反应生成E为
,X相对原子质量大于180-28-76-45=31,小于260-28-76=111,X可能为Cl或Br.C发生消去反应生成E为 ,E与氢气发生加成反应生成F.C发生缩聚反应生成高聚物H为
,E与氢气发生加成反应生成F.C发生缩聚反应生成高聚物H为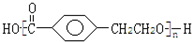 ,据此解答.
,据此解答.
解答 解:A与F分子中所含碳原子数相同,且均能与 NaHCO3溶液反应,均含有-COOH,F的分子式为C9H10O2,不饱和度为$\frac{2×9+2-10}{2}$=5,且不能使溴的CCl4溶液褪色,不含不饱和键,应含有苯环,F发生氧化反应生成M,M与NaOH溶液反应后的产物,其一氯代物只有一种,故F中应含有乙基,且与羧基处于对位,故F为 ,M为
,M为 .由A→B→C的转化可知,C中含有-COOH,C发生氧化反应生成D,D能发生银镜反应,结合F的结构可知,C为
.由A→B→C的转化可知,C中含有-COOH,C发生氧化反应生成D,D能发生银镜反应,结合F的结构可知,C为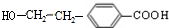 ,故D为
,故D为 ,B为
,B为 ,A的相对分子质量在180〜260之间,故A中苯环上的乙基中不可能连接羟基,应为卤素原子,A的结构为
,A的相对分子质量在180〜260之间,故A中苯环上的乙基中不可能连接羟基,应为卤素原子,A的结构为 ,X相对原子质量大于180-28-76-45=31,小于260-28-76=111,X可能为Cl或Br.C发生消去反应生成E为
,X相对原子质量大于180-28-76-45=31,小于260-28-76=111,X可能为Cl或Br.C发生消去反应生成E为 ,E与氢气发生加成反应生成F.C发生缩聚反应生成高聚物H为
,E与氢气发生加成反应生成F.C发生缩聚反应生成高聚物H为 .
.
(1)由上述分析可知,B的结构简式为 ,
,
故答案为: ;
;
(2)反应①属于取代反应,还发生中和反应,反应②属于复分解反应,反应③⑥属于氧化反应,反应④属于消去反应,反应⑤属于加成反应,反应⑦属于缩聚反应,
故答案为:③⑥;
(3)反应④的化学方程式: ,
,
故答案为: ;
;
(4)D与新制Cu(OH)2悬浊液反应的化学方程式为: ,
,
故答案为: ;
;
(5)根据上面的分析可知,X可能为Cl或Br,要确定X是哪种官能团的实验方法为,在氢氧化钠水溶液、加热条件下发生水解反应,或者在氢氧化钠醇溶液、加热条件下发生取代反应,取反应后的混合液少许,向其中加入稀HNO3至酸性,滴加AgNO3溶液,若生成白色沉淀,则A中含氯原子,若生成浅黄色沉淀,则A中含溴原子,
故选:bd;
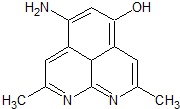
(6)F( )的同分异构体:a.能发生银镜反应,说明分子中存在醛基;b.能与FeCl3溶液发生显色反应,说明分子中存在酚羟基;c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6,说明有4种氢原子,符合以上条件的F分子中有2个甲基、1个酚羟基、1个-CHO,酚羟基、醛基处于对位,2个甲基关于酚羟基、-CHO连线呈轴对称,所以F的同分异构体有2种,
)的同分异构体:a.能发生银镜反应,说明分子中存在醛基;b.能与FeCl3溶液发生显色反应,说明分子中存在酚羟基;c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6,说明有4种氢原子,符合以上条件的F分子中有2个甲基、1个酚羟基、1个-CHO,酚羟基、醛基处于对位,2个甲基关于酚羟基、-CHO连线呈轴对称,所以F的同分异构体有2种,
故答案为:2.
点评 本题考查有机推断、有机反应类型、同分异构体、化学方程式的书写等,综合分析确定F的结构是关键,较好的考查学生分析推理能力,需要学生熟练掌握官能团的性质与转化,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
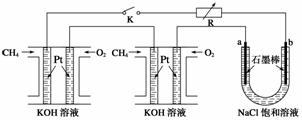 水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
水煤气(CO 和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅤⅠA | ⅤⅡA | O |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 四 | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | 该元素的一种核素无中子 |
| B | 基态原子核外只有三个能级,且各能级电子数相等 |
| C | 基态原子最外层电子数是其内层电子总数的2.5倍 |
| D | 一个D-离子含18个电子 |
| E | +3价离子3d能级为半充满 |
 .
. ,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.
,C的氢化物在同族元素中氢化物的沸点出现反常,其原因是NH3分子间易形成氢键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)第二周期元素中,第一电离能介于B和O之间的元素有Be、C.
(1)第二周期元素中,第一电离能介于B和O之间的元素有Be、C.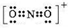 ,其等电子体有N2O、CO2(至少2种).
,其等电子体有N2O、CO2(至少2种).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com