
| A. | 0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,所得溶液呈碱性:c (Na+)>c (CN-)>c (HCN)>c (OH-)>c (H+) | |
| B. | 20 mL 0.1 mol/L的Na2CO3溶液与等体积等浓度的盐酸混合充分反应后的溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)=2c(Cl-)=0.1 mol/L | |
| C. | 浓度均为1 mol/L的以下溶液:①醋酸 ②NaOH溶液 ③盐酸 ④醋酸钠溶液,其水的电离程度的关系为:④>①>③>② | |
| D. | 相同温度下,pH值相同的CH3COONa溶液与NaHCO3溶液一定存在关系:c(CH3COO-)=c(HCO3-)+2c(CO32-) |
分析 A.混合溶液中的溶质是等物质的量的HCN和NaCN,溶液呈碱性,说明酸根离子水解程度大于酸的电离程度;
B.20 mL 0.1 mol/L的Na2CO3溶液与等体积等浓度的盐酸混合充分反应后得到碳酸氢钠和氯化钠的混合溶液,溶液中存在物料守恒分析;
C.酸和碱对水的电离起抑制作用,能水解的盐对水的电离起促进作用;
D.相同温度下,pH值相同的CH3COONa溶液与NaHCO3溶液,醋酸根离子水解程度小于碳酸氢根离子,则溶液浓度CH3COONa溶液大于NaHCO3溶液,依据溶液中电荷守恒分析大小.
解答 解:A.混合溶液中的溶质是等物质的量的HCN和NaCN,溶液呈碱性,则c(OH-)>c(H+),酸根离子水解程度大于酸的电离程度,弱电解质的电离和盐类水解程度都较小,钠离子不水解,所以离子浓度大小顺序是c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+),故A错误;
B.20 mL 0.1 mol/L的Na2CO3溶液与等体积等浓度的盐酸混合充分反应后得到等浓度的NaCl和NaHCO3溶液,溶液中物料守恒为:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)=2c(Cl-)=0.1 mol/L,故B正确;
C.盐酸为强酸、醋酸为弱酸,浓度均为1mol/L,盐酸的抑制作用大于醋酸的抑制作用,氢氧化钠溶液为强碱溶液,溶液中氢氧根离子浓度和盐酸溶液中氢离子浓度相同,对水的电离平衡抑制程度相同,④醋酸钠溶液中电离出的醋酸根离子水解会促进水的电离,所以水电离程度的顺序为④>①>③=②,故C错误;
D.相同温度下,pH值相同的CH3COONa溶液与NaHCO3溶液,醋酸根离子水解程度小于碳酸氢根离子,则溶液浓度CH3COONa溶液大于NaHCO3溶液,CH3COONa溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),NaHCO3溶液中存在电荷守恒c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),氢氧根离子浓度相同,氢离子浓度相同,醋酸钠溶液中钠离子浓度大于碳酸氢钠溶液中钠离子浓度,得到c(CH3COO-)>c(HCO3-)+2c(CO32-),故D错误;
故选B.
点评 本题考查了电解质溶液中离子浓度大小,电解质溶液中物料守恒、电荷守恒和离子浓度大小比较,题目难度中等.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是
A.Na+、K+、OH-、Cl- B.Na+、Cu2+、SO42-、NO3-
C.Mg2+、Na+、SO42-、Cl- D.Ba2+、HCO3-、NO3-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温恒容,充入N02气体,其转化率增大 | |
| B. | 加压,平衡向逆反应方向移动,混合气体颜色变深 | |
| C. | 若平衡常数增大,则可能是升高了温度或减小了体系的压强 | |
| D. | 当2v正(NO)=v逆(O2)时,反应达到化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
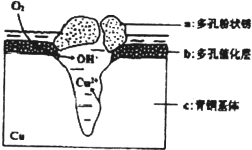 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境腐蚀,欲对其进行修复和防护具有重要意义.
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境腐蚀,欲对其进行修复和防护具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
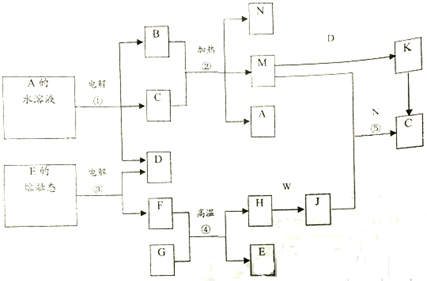
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
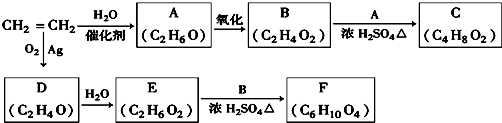
 CH3COOC2H5+H2O,该反应的类型为酯化反应(或取代反应);
CH3COOC2H5+H2O,该反应的类型为酯化反应(或取代反应); ;D的一种同分异构体的结构简式为CH3CHO.
;D的一种同分异构体的结构简式为CH3CHO.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠与盐酸反应 | B. | 氧化铁与一氧化碳在高温下反应 | ||
| C. | 氧化铜与硫酸反应 | D. | 铁粉与硫酸铜溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
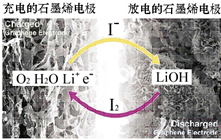 科学家开发出一种新型锂-氧电池,其能量密度极高,效率达90%以上.电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$ 2I2+4LiOH
科学家开发出一种新型锂-氧电池,其能量密度极高,效率达90%以上.电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O$?_{充电}^{放电}$ 2I2+4LiOH| A. | 放电时负极上I- 被氧化 | |
| B. | 充电时Li+从阳极区移向阴极区 | |
| C. | 充电时阴极反应为LiOH+e-═Li+OH- | |
| D. | 放电时正极反应为O2+2H2O+4Li++4e-═4LiOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
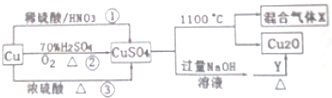
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com