
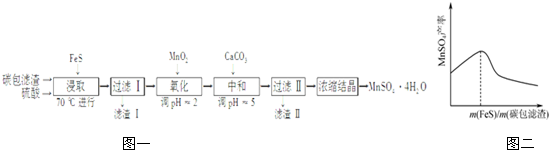
分析 碳包滤渣(含MnO2、C、Hg2+等),加入FeS在70℃浸取发生反应:9MnO2+2FeS+10H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$9MnSO4+Fe2(SO4)3+10H2O,过滤滤渣Ⅰ的成分为MnO2、HgS和C,溶液中含有MnSO4、Fe2(SO4)3,加入MnO2继续氧化残留的Fe2+,发生反应2Fe2++MnO2+4H+═2Fe3++Mn2++2H2O,Fe3+水解:Fe3++3H2O?Fe(OH)3+3H+,加入CaCO3,CaCO3与H+反应消耗H+,促使Fe3+水解平衡右移,调节溶液PH在PH=5,可使Fe3+完全沉淀,并防止Mn2+转化为Mn(OH)2沉淀,滤液溶质为MnSO4,浓缩结晶得到MnSO4•4H2O,
(1)根据题干信息反应物为MnO2、FeS、H2SO4,生成物为MnSO4、Fe2(SO4)3,结合氧化还原得失电子守恒和原子守恒分析解答;
(2)碳包滤渣(含MnO2、C、Hg2+等),根据所示实验流程图可知:滤渣Ⅰ的成分为MnO2、HgS和C,若浸取反应在25℃时进行,FeS足量,根据Ksp(FeS)、Ksp(HgS)计算充分浸取后溶液中c(Hg2+)/c(Fe2+);
(3)“氧化”时,溶液中Fe2+转化为Fe3+,MnO2转化为Mn2+,结合氧化还原得失电子守恒和原子守恒分析解答;结合水解平衡移动分析滤渣Ⅱ的主要成分为Fe(OH)3;
(4)浸出液中残存大量S2-,容易与Mn2+生成MnS沉淀,所以FeS用量超过最佳值时,MnSO4产率反而变小.
解答 解:(1)MnO2和FeS在酸性条件下发生氧化还原反应,Mn(+4→+2),1molMnO2得到2mole-,Fe(+2→+3),S(-2→+6)1molFeS失去9mole-,最小公倍数为18,所以化学方程式为:9MnO2+2FeS+10H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$9MnSO4+Fe2(SO4)3+10H2O,
故答案为:9MnO2+2FeS+10H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$9MnSO4+Fe2(SO4)3+10H2O;
(2)碳包滤渣(含MnO2、C、Hg2+等),加入FeS在70℃浸取发生反应:9MnO2+2FeS+10H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$9MnSO4+Fe2(SO4)3+10H2O,同时硫离子和汞离子结合生成HgS沉淀,碳和FeS、H2SO4不反应,所以滤渣Ⅰ的成分为MnO2、HgS和C,若浸取反应在25℃时进行,FeS足量,则充分浸取后溶液中S2-浓度相同,溶液中c(Hg2+)/c(Fe2+)=$\frac{{K}_{sp}(HgS)}{{K}_{sp}(FeS)}$=$\frac{2×1{0}^{-54}}{5×1{0}^{-18}}$=4×10-37,
故答案为:C;4×10-37;
(3)“氧化”时,溶液中Fe2+转化为Fe3+,MnO2转化为Mn2+,Mn(+4→+2),1molMnO2得到2mole-,Fe(+2→+3),最小公倍数为2,所以化学方程式为:2Fe2++MnO2+4H+═2Fe3++Mn2++2H2O,Fe3+水解:Fe3++3H2O?Fe(OH)3+3H+,加入CaCO3,CaCO3与H+反应消耗H+,促使Fe3+水解平衡右移,调节溶液PH在PH=5,可使Fe3+完全沉淀,所以滤渣Ⅱ的主要成分为Fe(OH)3,
故答案为:2Fe2++MnO2+4H+═2Fe3++Mn2++2H2O;Fe(OH)3;
(4)浸出液中残存大量S2-,容易与Mn2+生成MnS沉淀,所以FeS用量超过最佳值时,MnSO4产率反而变小,
故答案为:浸出液中残存大量S2-,容易与Mn2+生成MnS沉淀.
点评 本题考查了物质制备方案的设计流程分析判断,掌握离子的性质和调节溶液PH除去杂质离子是解题关键,注意沉淀溶解平衡原理的应用,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
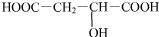 $→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O
$→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O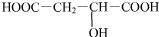 +2NaHCO3→
+2NaHCO3→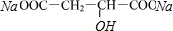 +2H2O+2CO2↑
+2H2O+2CO2↑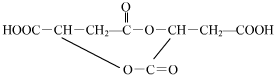 ,
,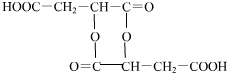 (或
(或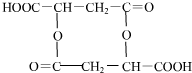 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,H2+Cl2=2HCl在光照和点燃条件的△H不同 | |
| B. | 铅蓄电池在放电过程中,负极质量减小,正极质量增加 | |
| C. | 天然气、沼气和水煤气分别属于化石能源、可再生能源和一级能源 | |
| D. | 元素原子的核外电子排布呈周期性变化是元素性质呈现周期性变化的根本原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 开始沉淀pH | 完全沉淀pH | |
| Fe(OH)2 | 6.5 | 9.7 |
| Fe(OH)3 | 2.5 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率 | |
| B. | 制肥皂时,在皂化液里加入饱和食盐水,能够促进高级脂肪酸钠的析出 | |
| C. | 实验室制取乙烯时将温度计的水银球放在反应液面上,温度 170℃时收集气体 | |
| D. | 重结晶法提纯苯甲酸时,为除去杂质和防止苯甲酸析出,应该趁热过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鸡蛋清和淀粉可以用浓硝酸鉴别 | |
| B. | 用甘氨酸和丙氨酸缩合最多可形成4种二肽 | |
| C. | 分子式为C5H8O2,既与碳酸钠溶液反应又与溴的四氯化碳溶液反应的有机物有8种 | |
| D. | 乳酸薄荷醇酯(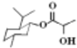 )仅能发生水解、氧化、消去反应 )仅能发生水解、氧化、消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com