
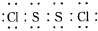 ,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如表:
,它不稳定,在水中易发生岐化反应(一部分硫元素价态升高,一部分降低).反应涉及的几种物质的熔沸点如表:| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
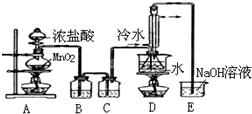
分析 制备S2Cl2原理是:在装置A中二氧化锰和浓盐酸之间反应得到氯气,但是氯气中混油HCl和水,应该先用饱和食盐水除去HCl(装置B),再用浓硫酸干燥氯气(装置C),让氯气和二硫化碳在一定温度下发生反应(装置D):2S+Cl2$\stackrel{95-100℃}{→}$S2Cl2,为了使CS2平稳汽化,避免产物S2Cl2汽化,采用热水浴加热的方法,根据S2Cl2的熔沸点数据,采用冷凝回流的办法将之收集即可试验中的氯气要进行尾气处理,可以用氢氧化钠来吸收.
(1)二氧化锰和浓盐酸加热反应生成氯气、水和氯化锰;
(2)二氧化锰和稀盐酸不反应;
(3)根据物质的制备实验结合装置的性质来回答;
(4)氯气中的HCl以及水杂质应该除去,根据表中物质的沸点高低可以进行物质的分离;
(5)实验中的处理方案以及实验结束的安全措施要引起注意;
(6)根据题干信息:S2Cl2在水中易发生岐化反应来书写反应方程式,在酸性环境下,氯离子和次氯酸根离子之间可以发生归中反应得到氯气.
解答 解:(1)用固液加热的方法制Cl2,常用浓盐酸和二氧化锰反应制取,反应离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)实验中盐酸通常采用36.5%的浓溶液,不用稀盐酸,因为稀盐酸还原性弱,反应困难,故答案为:稀盐酸还原性弱,反应困难;
(3)D中冷凝管起到导气和冷凝回流双重作用,此作用在制取乙酸乙酯和溴苯、石油分馏的试验中用得到,故答案为:ACD;
(4)制取氯气时,其中的HCl杂质应该用饱和食盐水除去,根据表中物质的沸点高低,为了使CS2平稳汽化,避免产物S2Cl2汽化,可以采用水浴加热的方法,结束后从锥形瓶内混合物中分离出S2Cl2的方法是蒸馏,控制温度在137℃,
故答案为:饱和食盐水;蒸馏;使CS2平稳汽化,避免产物S2Cl2汽化;
(5)A装置仪器装配时,整套装置装配完毕后,应先进行气密性的检查,再添加试剂.实验完毕,拆除装置时,为防止倒吸,应先将E中长导管移开液面,
故答案为:气密性检查;防止倒吸;
(6)S2Cl2与水反应,有无色刺激性气味气体产生,并有黄色沉淀生成,无色刺激性气味气体除氯化氢外,依据氧化还原反应的元素化合价变化守恒推断,化合价降低的生成黄色沉淀为单质硫,化合价升高的生成二氧化硫气体,依据原子守恒、电子守恒写出化学方程式为:2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑,吸收了氯气的氢氧化钠溶液中含有氯化钠、次氯酸钠,向其中加入浓盐酸,则在酸性环境下,氯离子和次氯酸根离子之间可以发生归中反应得到氯气,反应为:ClO-+2H++Cl-=Cl2↑+H2O,
故答案为:2S2Cl2+2H2O=3S↓+SO2↑+4HCl↑;ClO-+2H++Cl-=Cl2↑+H2O.
点评 本题考查物质的制备,为高考常见题型,题目涉及混合物分离的方法判断,杂质气体除杂的装置选择和试剂选择,题干信息的应用分析,离子方程式书写,关键是掌握整个制备流程原理,分析流程中各装置的作用.要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,题目难度中等.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42-离子浓度增大 | |
| B. | 步骤①中当溶液呈现深黄色,且2v(CrO${\;}_{4}^{2-}$)=v(Cr2O72-)时,说明反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O 达到平衡状态 | |
| C. | 步骤②中,若要还原1 mol Cr2O${\;}_{7}^{2-}$离子,需要6 mol(NH4)2Fe(SO4)2•6H2O | |
| D. | 步骤③中,当将溶液的pH 调节至4 时,可认为废水中的铬元素已基本除尽 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
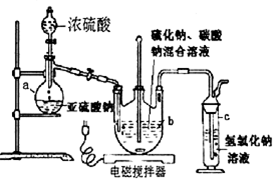
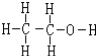 .
.| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
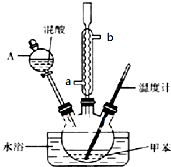 某实验小组用下图所示的装置制备一硝基甲苯(含邻硝基甲苯和对硝基甲苯):
某实验小组用下图所示的装置制备一硝基甲苯(含邻硝基甲苯和对硝基甲苯):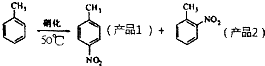
| 密度g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 产品1 | 1.286 | 237.7 | 不溶于水,易溶于液体烃 |
| 产品2 | 1.162 | 222 | 不溶于水,易溶于液体烃 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置. | 溶液变浑浊,则证明固体中含有(NH4)2CO3. |
| 步骤3:取步骤2的上层清液于试管中加入少量的Ba(OH)2溶液. | 溶液不变浑浊,则证明固体中不含有NH4HCO3. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
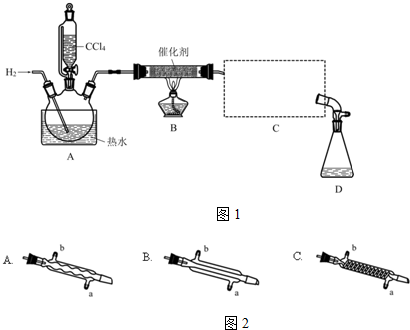
| 物质 | 相对分子质量 | 密度/(g•mL-1) | 沸点/℃ | 水中溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
| CCl4 | 154 | 1.59 | 76.7 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| H2C2O4 | 无色晶体 | K1=5.9×10-2,K2=6.4×10-5,能溶于水和乙醇 |
| Na2C2O4 | 白色晶体 | 微溶于水,pH=7.2,不溶于乙醇 |
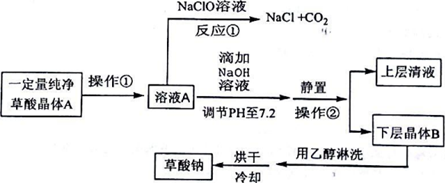
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
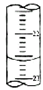 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;| 滴定次数 | 待测液体(mL) | 标准盐酸体积(mL) | |
| 滴定前读(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com