
(1)反应前混合气体中N2和H2的体积比。
(2)达到平衡时混合气体中氨的物质的量。
(3)平衡时N2的转化率。
思路解析:根据参加反应的气体体积之比等于物质的量之比、方程式前面的系数之比。列方程式找起始、转化、平衡时体积之间的关系,据已知条件列方程即可求解。
解:(1)混合气体的平均摩尔质量:![]() =3.6×2 g·mol-1=7.2 g·mol-1
=3.6×2 g·mol-1=7.2 g·mol-1
根据十字交叉法:![]()
(2)设达到平衡时消耗N2的物质的量为x mol
N2 + 3H2 ![]() 2NH3
2NH3
起始 0.1 mol 0.4 mol 0
转化 x mol 3x mol 2x mol
平衡 0.1 mol-x mol 0.4 mol-3x mol 2x mol
![]() =0.76
=0.76
x=0.06 mol
NH3的物质的量为0.12 mol
(3)N2的转化率=![]() ×100%=60%
×100%=60%
答案:(1)1∶4;(2)0.12 mol;(3)60%。


科目:高中化学 来源: 题型:
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
| 1 |
| 7 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| N2(mol?L-1) | H2(mol?L-1) | NH3(mol?L-1) | |
| 起始时 | 3 | 3 | 0 |
| 2s末 | 2.6 | 1.8 | 0.8 |
 2NH3
2NH3 2NH3
2NH3查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| 高温 |
| ||
| 高温 |
| 4 |
| 7 |
| ||
| 高温 |
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 催化剂 |
| 高温高压 |
| ||
查看答案和解析>>
科目:高中化学 来源:2011-2012学年辽宁省、庄河高中高三上学期期末联考卷三化学试卷 题型:填空题
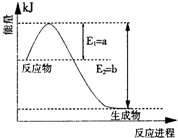
(11分)对于可逆反应:N2
(g) +3H2(g)  2NH3(g) 能量变化如右图,回答下列问题:
2NH3(g) 能量变化如右图,回答下列问题:

(1)在反应体系中加入催化剂,反应速率增大,E2和△H的变化是:E2 ,△H (填“增大”、“减小”、“不变”)
(2)在500℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5mol N2和1.5mol H2,充分反应后,放出的热量 (填“<”、“>”或“=”)46.2kJ。
(3)关于该反应的下列说法中,正确的是 。
A.△H>0,△S>0 B.△H>0,△S< 0 C.△H<0,△S>0 D.△H<0,△S<0
(4)将一定量的N2和H2放入 1L密闭容器中,在500℃、2×107Pa下达到平衡,欲提高合
成氨中H2的转化率,下列措施可行的是 (填字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入惰性气体
C.改变反应的催化剂 D.分离出氨
(5)在一定温度、压强和有催化剂存在的条件下将1 mol N2和2.5 mol H2 放入500ml密闭容器中,经过20min达到平衡,平衡后NH3 的浓度为2mol/L,则用N2 表示20min内的平均反应速率为:_____________,该温度下此反应的平衡常数K=___________,H2 的转化率为____________。如果保持温度不变,再向容器中同时充入1.5mol N2和1mol NH3,H2的转化率将______________(填“升高”、“不变”或“降低”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com