

分析 (1)丙烯分子中含有碳碳双键,在一定条件下能够发生加聚反应生成聚丙烯,据此写出该反应的化学方程式;
(2)苯酚钠溶液通入二氧化碳反应生成苯酚和碳酸氢钠;
(3)乙醇在铜的催化氧化下生成乙醛和水,乙二醇中含有两个可被氧化的端基醇,据此解答;
(4)碳酸根离子为二元弱酸酸根离子,分步水解生成碳酸和氢氧根离子.
解答 解:(1)聚丙烯分子中含有不饱和的碳碳双键,在一定条件下能够发生加聚反应得到聚丙烯,反应的化学方程式为: ,
,
故答案为: ;
;
(2)二氧化碳通入苯酚钠溶液反应生成苯酚和碳酸氢钠,反应的化学方程式为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,离子反应为C6H5O-+CO2+H2O→C6H5OH+HCO3-,
故答案为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3或C6H5O-+CO2+H2O→C6H5OH+HCO3-;
(3)乙二醇一定条件下催化氧化得到乙二醛,化学反应方程式为:CH2OH-CH2OH+O2$→_{△}^{催化剂}$CHO-CHO+2H2O,
故答案为:CH2OH-CH2OH+O2$→_{△}^{催化剂}$CHO-CHO+2H2O;
(4)碳酸根离子为二元弱酸酸根离子,分步水解:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,
故答案为:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-.
点评 本题考查反应方程式书写,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,侧重有机物性质及反应的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=1,b=2 | B. | a=2,b=1 | C. | a=2,b=2 | D. | a=3,b=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
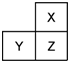 X、Y、Z是三种短周期的主族元素,在周期表中的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )
X、Y、Z是三种短周期的主族元素,在周期表中的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是( )| A. | 气态氢化物的热稳定性:X>Z | |
| B. | 原子半径:X<Y<Z | |
| C. | Y和Z的最高价氧化物对应水化物均为强酸 | |
| D. | 若Z的最高正价为+m,则X的最高正价也一定为+m |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{7}{4}g$ | B. | 4.7 g | C. | 7.4 g | D. | $\frac{4}{7}g$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸具有强氧化性,可以起到除去水中悬浮的杂质和杀菌消毒作用 | |
| B. | 为防止中秋月饼等富脂食品氧化变质,常在包装中放入生石灰 | |
| C. | 金属汞一旦洒落在地面或桌面时,必须尽可能收集,并深埋处理 | |
| D. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g H2和10g O2 | B. | 标准状况下相同体积的N2和H2 | ||
| C. | 9g水和0.25mol H2 | D. | 22g CO2和3.01×1023个N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com