
| A.化学反应速率 | B.化学反应的平衡常数 |
| C.水的离子积 | D.吸热反应反应物的转化率 |
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用反应热数据的大小判断不同反应反应速率的快慢 |
| B.用pH数据推测相同浓度的不同强酸弱碱盐在水溶液中水解程度的大小 |
| C.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| D.用平衡常数的大小判断化学反应可能进行的程度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) ΔH
CH3OH(g) ΔH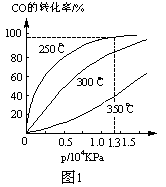
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
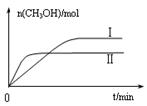
 CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H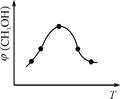
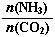 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 HOCH2-CH2OH(g)+2CH3OH(g) △H =" -34" kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g) △H =" -34" kJ/mol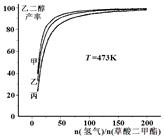
 H++OH-、HC2O4-
H++OH-、HC2O4- H++C2O42-和 。
H++C2O42-和 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
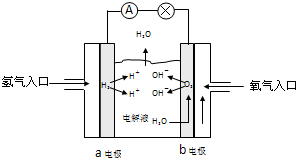
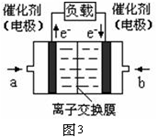
 2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。
2NH3(g),则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;向另一电极通入N2,该电极的反应式为__________________________。 4NH3(g)+3O2(g) △H=Q。
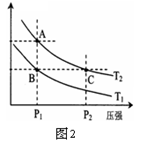
4NH3(g)+3O2(g) △H=Q。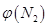 与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
与反应温度T的关系曲线如图所示,则上述反应的Q________0(填“>”、“<”或“=”)。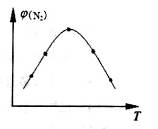
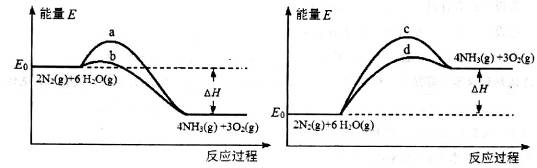
 2NH3(g) △H=-93.0kJ/mol。
2NH3(g) △H=-93.0kJ/mol。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铅蓄电池在放电过程中,正负极质量均增加 |
| B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H> O |
| C.25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小 |
D.将浓度为0.1mol·L-1的HF溶液加水不断稀释,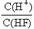 的值始终保持增大 的值始终保持增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 4NO2(g)+O2(g);ΔH>0
4NO2(g)+O2(g);ΔH>0| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol·L-1 | 5.00 | 3.52 | 2.48 |
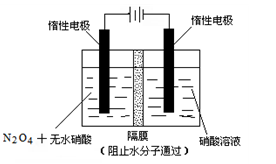
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com