
【题目】次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:______________________。
(2)H3PO2及NaH2PO2均可将AgNO3溶液中的Ag+ 还原为银,从而可用于化学镀银。
①H3PO2中,磷元素的化合价为______。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,写出该反应的化学方程式,并在方程式中用单线桥表示该反应的电子转移:_______。
③NaH2PO2为____________ (填“正盐”或“酸式盐”)。
【答案】H3PO2![]() H++H2PO2- +1
H++H2PO2- +1 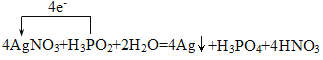 正盐
正盐
【解析】
(1)H3PO2是一元中强酸,则电离时,只能电离出一个H+,且反应物与生成物间用“![]() ”连接。
”连接。
(2)① H3PO2中,H显+1价,O显-2价,依据化合物中各元素化合价的代数和为0,求出磷元素的化合价。
② 利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,该反应氧化剂为AgNO3,还原剂为H3PO2,产物为Ag、H3PO4,H3PO4是由得失电子守恒得出,再根据质量守恒,添加其它的反应物和生成物;单线桥表示的电子转移是从反应物中失电子元素指向反应物中的得电子元素。
③ 因为H3PO2是一元中强酸,所以NaH2PO2为正盐。
(1)H3PO2是一元中强酸,则电离时,只能电离出一个H+,电离方程式为H3PO2![]() H++H2PO2-。答案为:H3PO2
H++H2PO2-。答案为:H3PO2![]() H++H2PO2-;
H++H2PO2-;
(2)① H3PO2中,H显+1价,O显-2价,依据化合物中各元素化合价的代数和为0,磷元素的化合价为+1价。答案为:+1;
② 利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,该反应氧化剂为AgNO3,还原剂为H3PO2,产物为Ag、H3PO4,H3PO4是由得失电子守恒得出,再根据质量守恒,添加其它的反应物和生成物,反应的化学方程式为4AgNO3+H3PO2+2H2O=4Ag+H3PO4+4HNO3;单线桥表示的电子转移方向和数目为:
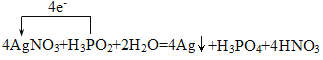
答案为: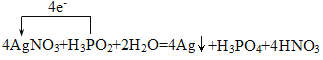
③ 因为H3PO2是一元中强酸,所以NaH2PO2为正盐。答案为:正盐。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】在粗食盐中除泥沙外,还含Na2SO4、MgCl2、CaCl2等杂质,工业制精盐除杂时,常常加入过量的除杂剂,现提供下列试剂:a.NaOH溶液;b.盐酸;c.BaCl2溶液;d.Na2CO3溶液,则加入试剂和操作不正确的是( )
A.粗盐![]() 粗盐水
粗盐水![]()
![]()
![]() 滤液
滤液![]() 精盐
精盐
B.粗盐![]() 粗盐水
粗盐水![]()
![]()
![]() 滤液
滤液![]() 精盐
精盐
C.粗盐![]() 粗盐水
粗盐水![]()
![]()
![]() 滤液
滤液![]() 精盐
精盐
D.粗盐![]() 粗盐水
粗盐水![]()
![]()
![]() 滤液
滤液![]() 精盐
精盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有AlCl3和MgSO4混合溶液,向其中不断加入NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如下图所示。原溶液中Cl-与SO42-的物质的量之比为( )
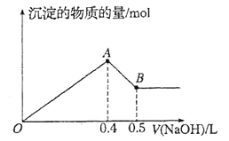
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是_______________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究硫元素及其化合物的性质具有重要意义。
(1)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与[S2-]关系如下图(忽略溶液体积的变化、H2S的挥发)。
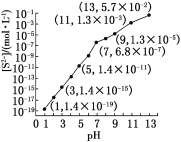
①pH=13时,溶液中的[H2S]+[HS-]=__________mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=____________时,Mn2+开始沉淀[已知:Ksp(MnS)=2.8×10-13]。
(2)25 ℃,两种酸的电离平衡常数如下表。
物质 | Ka1 | Ka2 |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO的电离平衡常数表达式K=________。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为____________________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关,下列关于生活中遇到的化学问题的描述不正确的是( )
A. 曾经风靡一时的DDT是卤代烃的一种
B. 维纶、油脂、天然橡胶、脲醛树脂都是由高分子化合物组成的物质
C. 甲醛水溶液可以防腐,但是不能用于食品类的保鲜剂
D. 可以将浸泡过高锰酸钾溶液的硅藻土于水果一起保存来达到水果保鲜的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]
高锰酸钾(![]() )是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
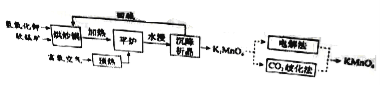
回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 。
(2)“平炉”中发生的化学方程式为 。
(3)“平炉”中需要加压,其目的是 。
(4)将K2MnO4转化为KMnO4的生产有两种工艺。
①“![]() 歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4,MnO2和 (写化学式)。
歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4,MnO2和 (写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为
,阴极逸出的气体是 。
③“电解法”和“![]() 歧化法”中,K2MnO4的理论利用率之比为 。
歧化法”中,K2MnO4的理论利用率之比为 。
(5)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48 mL,该样品的纯度为
(列出计算式即可,已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室现需配制物质的量浓度为 1 mol/L 的 NaOH 溶液 480 mL。
(1)配制该溶液的实验步骤包括:
a.计算需要氢氧化钠固体的质量;
b.称量氢氧化钠固体;
c.将烧杯中的溶液注入容量瓶中,洗涤烧杯和玻璃棒,将洗涤液全部转移入容量瓶中;
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却;
e.盖好瓶塞,反复上下颠倒,摇匀;
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用________滴加蒸馏水至凹液面与刻度线相切。上述步骤的正确操作顺序是________。
(2)使用________mL的容量瓶配制此溶液,需要称量NaOH固体的质量为________g。
(3)下列操作会使所配制溶液浓度偏小的有________。
A 容量瓶中原有少量蒸馏水
B 转移溶液时,没有洗涤玻璃棒和溶解用的烧杯
C 定容摇匀后,静置时发现液面低于刻度线,又加水至刻度线
D 定容时,俯视观察液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,则下列说法正确的是( )
A. 0.1 mol/L K2SO4溶液含有K+ 0.2NA
B. 标准状况下,11.2L水所含的电子数为5NA
C. 常温常压下,16g O2含电子数为10NA
D. 0.1 mol Mg原子变成Mg2+时失去的电子数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com