
分析 (1)乙烯中含碳碳双键;
(2)苯与溴的四氯化碳溶液不反应,互溶不分层;
(3)乙醇的分子式为C2H6O,完全燃烧消耗氧气为1mol×(2+$\frac{6}{4}$-$\frac{1}{2}$).
解答 解:(1)乙烯中含碳碳双键,能与溴发生加成反应,则乙烯通入溴的四氯化碳溶液中,振荡,溶液褪色,发生的反应为加成反应,故答案为:加成反应;
(2)苯与溴的四氯化碳溶液不反应,互溶不分层,则将苯滴入溴的四氯化碳溶液中,振荡,溶液不褪色,故答案为:不褪色;
(3)乙醇的分子式为C2H6O,完全燃烧消耗氧气为1mol×(2+$\frac{6}{4}$-$\frac{1}{2}$)=3mol,故答案为:3.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注重基础知识的夯实和训练,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1.2 g NaHSO4晶体中阳离子和阴离子的总数为0.03 NA | |
| B. | 25℃时,1L pH=1的硫酸溶液中,含有H+的数目为0.2NA | |
| C. | 2mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4NA | |
| D. | 含1mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶质的电离方程式为KHXOn═K++H++XOn2- | |
| B. | 该溶液中水的电离程度比纯水的小 | |
| C. | 该溶液能与NaOH溶液发生中和反应 | |
| D. | 若该溶液显酸性,则K1•K2>10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 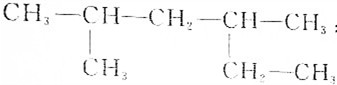 :2,4-二甲基已烷 :2,4-二甲基已烷 | |
| B. | 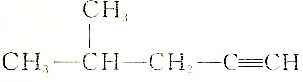 :2-甲基-4-戊炔 :2-甲基-4-戊炔 | |
| C. | 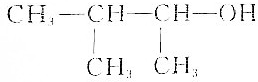 :3-甲基-2-丁醇 :3-甲基-2-丁醇 | |
| D. | CH2-CHBr-CHBr-CH3:2,3-二溴丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
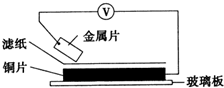 将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下:
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下:| 金属 | 电子流动方向 | 电压/V |
| 甲 | 甲→Cu | +0.78 |
| 乙 | Cu→乙 | -0.15 |
| 丙 | 丙→Cu | +1.35 |
| 丁 | 丁→Cu | +0.30 |
| A. | 在四种金属中丙的还原性最强 | |
| B. | 金属乙能从硫酸铜溶液中置换出铜 | |
| C. | 甲、丁若形成原电池时,甲为正极 | |
| D. | 甲、乙形成合金时,将该合金露置在空气中,乙先被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:6I-+8H++2NO3-=3I2+4H2O+2NO↑ | |
| B. | 非金属元素形成的化合物一定是共价化合物 | |
| C. | SO2通入Ca(ClO)2溶液中:SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO | |
| D. | 只含有共价键的物质一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com