
| A. | A的物质的量浓度不再改变 | |
| B. | 混合气的密度不再随时间而变化 | |
| C. | 容器内的压强不随时间而变化 | |
| D. | 平衡混合气体的平均相对分子质量不再改变 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、A的物质的量浓度不再改变,说明正逆反应速率相等,达平衡状态,故A不选;
B、混合气的密度一直不随时间而变化,所以不能说明已达平衡状态,故B选;
C、容器内的压强不随时间而变化,说明气体的物质的量不变,反应达平衡状态,故C不选;
D、平衡混合气体的平均相对分子质量不再改变,说明气体的物质的量不变,反应达平衡状态,故D不选;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


科目:高中化学 来源: 题型:解答题
 主族元素W、X、Y、Z的原子序数依次增大,W原子最外层电子数是次外层的3倍,X,Y和Z分属于不同的周期,它们的原子序数之和是W原子序数的5倍.在由元素W、X、Y、Z组成的所有二组分化合物中,由元素W、Y形成的化合物M的熔点最高.请回答下列问题:
主族元素W、X、Y、Z的原子序数依次增大,W原子最外层电子数是次外层的3倍,X,Y和Z分属于不同的周期,它们的原子序数之和是W原子序数的5倍.在由元素W、X、Y、Z组成的所有二组分化合物中,由元素W、Y形成的化合物M的熔点最高.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CDEBA | B. | ECDAB | C. | BAEDC | D. | CDBAE |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试验序号 | 实 验 步 骤 | 实 验 现 象 | 结 论 |
| ① | 取少量该焰火原料加入冷水 | 无明显现象 | 不含Li、Na等活泼金属 |
| ② | 取少量该焰火原料加入稀盐酸 | 完全溶解,有大量气体产生,溶液呈无色 | 可能含铍(Be)、镁(Mg)、铝(Al)三种金属中的任意两种 |
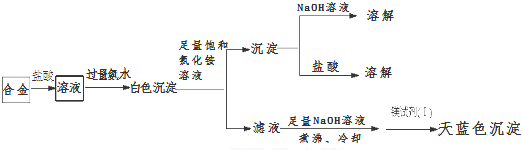

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁投入硫酸锌溶液中:Fe+Zn2+═Zn+Fe2+ | |
| B. | 钠投入硫酸铜溶液中:2Na+Cu2+═Cu+2Na+ | |
| C. | 往饱和Na2CO3溶液中逐滴加入少量稀盐酸:$CO_3^{2-}$+2H+═CO2↑+H2O | |
| D. | 钠投入冷水中:2Na+2H2O═2Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g Na2O2与足量水反应转移的电子数为0.2NA | |
| B. | 常温常压下,1 mol CH4中含有的氢原子数为4NA | |
| C. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA | |
| D. | 12.0 g熔融的NaHSO4中含有0.1NA个Na+、0.1NA个H+和0.1NA个SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.
某学习小组推测SO2能与强氧化剂Cl2反应生成SO2Cl2,为此进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com