
| A、原子序数X<Y |
| B、原子半径X>Y |
| C、原子的最外层电子数X>Y |
| D、元素的最高正价X<Y |


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
| A、氨气通入盐酸中:NH3+H+=NH4+ |
| B、少量铜屑放放稀硝酸中:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |
| C、少量SO2通入过量的烧碱溶液中:SO2+2OH-=SO32-+H2O |
| D、氢氧化铝粉末中滴入氨水:Al(OH)3+OH-=AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12.5g |
| B、13.2g |
| C、19.7g |
| D、24.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Br-.S2-.CO32-.K+ |
| B、Na+.NH4+.Cu2+.NO3- |
| C、Na+.K+.I-.Al3+ |
| D、Ba2+.Fe3+.Cl-.AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2mol?L-1的NaHCO3溶液:c(HCO3-)>c(CO32-)>0.1mol?L-1>c(H2CO3) |
| B、pH=2的HCl溶液与pH=12的氨水等体积混合:c(Cl-)>c(NH+4)>c(H+)>c(OH-) |
| C、0.2mol?L-1CH3COOH溶液和0.2mol?L-1CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)-c(H+)=0.1mol?L-1 |
| D、0.1mol?L-1Na2CO3溶液与0.1mol?L-1NaHCO3溶液等体积混合:c(CO32-)+2c(OH-)=c(HCO-3)+3c(H2CO3)+2c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
| 沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 周期 | ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测溶液的体积(mL) | 标准溶液的体积 | |
| 滴定前刻度(mL) | 滴定后刻度(mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.01 | 22.00 |
| 3 | 25.00 | 0.22 | 20.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:
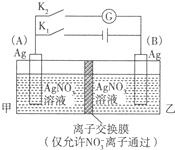 利用如图装置进行实验,甲乙两池均为1mol?L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K1,断开K2.一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针偏转(Ag+浓度越大氧化性越强).下列说法不正确的是( )
利用如图装置进行实验,甲乙两池均为1mol?L-1的AgNO3溶液,A、B均为Ag电极.实验开始先闭合K1,断开K2.一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针偏转(Ag+浓度越大氧化性越强).下列说法不正确的是( )| A、闭合K1,断开K2后,A电极增重 |
| B、闭合K1,断开K2后,乙池溶液浓度上升 |
| C、断开K1,闭合K2后,NO3-向B电极移动 |
| D、断开K1,闭合K2后,A电极发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com