
【题目】PdCl2广泛用作催化剂和一些物质的检测试剂。由Pd(NH3)2Cl2制备PdCl2工艺流程如图所示。
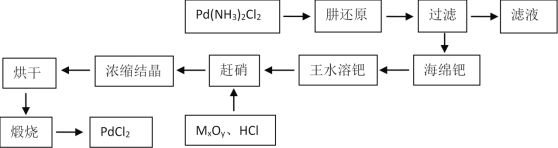
(1)肼(N2H4)可以被看作二元弱碱,结合质子生成N2H5+或N2H62+。肼与少量稀硫酸混合后,得到产物的化学式为_____________。
(2)对工艺流程图中的滤液处理办法最好的是:______
a.返到提钯废液中,循环使用 b.转化为无毒物质后排放 c.深埋于地下
(3)王水溶钯时,Pd被氧化为H2PdCl4。同时得到唯一还原产物亚硝酰氯(NOCl)。反应消耗的HCl与HNO3的物质的量之比为_____。
(4)赶硝,是将残余的NO3-浓度降低到不大于0.04%。实验数据记录如下:
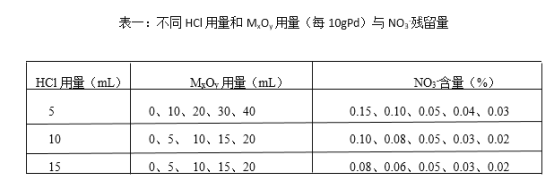
处理1吨Pd,需要用到HCl和MxOy的总体积至少为_______m3(合理选择表格里相关数据计算)。
(5)煅烧过程发生分解反应,化学方程式为:_______________________________。
(6)浸有磷钼酸铵溶液的氯化钯试纸遇微量CO立即变成蓝色。原理较为复杂,第一步是CO还原PdCl2得到Pd单质,同时有常见的氧化物生成。 写出反应原理中第一步的化学方程式:_________________________________
【答案】(N2H5)2SO4 a 5:1 2.5 H2PdCl4 ![]() PdCl2+2HCl↑ H2O+CO+PdCl2=Pd+CO2+2HCl
PdCl2+2HCl↑ H2O+CO+PdCl2=Pd+CO2+2HCl
【解析】
(1)硫酸少量,只能生成N2H5+,化学方程式为2N2H4+H2SO4= (N2H5)2SO4,故答案为:(N2H5)2SO4。
(2)对于工业流程中产生的废液应该循环使用,提高原料利用率,故a正确,故答案为:a。
(3)王水与Pd反应,氧化产物为H2PdCl4,还原产物为NOCl,化学方程式为5HCl+ HNO3+Pd= H2PdCl4+NOCl+2H2O,根据反应方程式可知反应消耗的HCl与HNO3的物质的量之比为5:1,故答案为:5:1。
(4)从实验结果可知,加入HCl的同时加入MxOy,可大大降低生成的PdCl2中的NO3-的含量,且MxOy用量越多,NO3-的含量越少,MxOy用量相同时,HCl的用量越大,PdCl2中的NO3-的含量越低。当每10gPd的HCl的用量为10mL, MxOy用量为15 mL时,NO3-的含量可降低至0.03%,达到处理标准,当处理量为1吨Pd时,需要用到HCl和MxOy的总体积至少为1×106g/(10g/10mL+15 mL)= 2.5×106 cm3= 2.5 m3,故答案为:2.5。
(5)在煅烧过程,会生成氯化氢气体和PdCl2,反应的化学方程式为H2PdCl4 ![]() PdCl2+2HCl↑,故答案为:H2PdCl4
PdCl2+2HCl↑,故答案为:H2PdCl4 ![]() PdCl2+2HCl↑。
PdCl2+2HCl↑。
(6)结合题干信息可推知常见氧化物为CO2,根据元素守恒可知,H2O参与反应,提供氧原子,反应的化学方程式为H2O+CO+PdCl2=Pd+CO2+2HCl。
故答案为: H2O+CO+PdCl2=Pd+CO2+2HCl。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,将3molA和1molB两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)=xC(g)+2D(g)。2 min时测得生成0.8 mol D、0.4 mol C。下列判断不正确的是
A. x=1
B. 2 min时,A的浓度为0.9mol·L-1
C. 2 min内A的反应速率为0.3 mol·L-1·min-1
D. B的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.
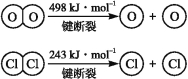
(1)反应A的热化学方程式是 。
(2)断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2.5mol A和2.5mol B混合盛入容积为2L的密闭容器里,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.2mol·L-1·s-1,同时生成1mol D,下列叙述中错误的是
xC(g)+2D(g),经5s反应达平衡,在此5s内C的平均反应速率为0.2mol·L-1·s-1,同时生成1mol D,下列叙述中错误的是
A. x=4
B. 达到平衡状态时容器内气体的压强与起始时压强比为6:5
C. 5s内B的反应速率V(B)=0.05mol·L-1·s-1
D. 达到平衡状态时A的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐( (NH4)2Fe(SO4)2·6H2O)广泛用于化学分析。溶于水,不溶于乙醇,在空气中比硫酸亚铁稳定,有还原性。现以废铁屑等为原料制备摩尔盐,并对产品中相关离子进行检测。
(一)制备过程如下:
步骤1:将废铁屑置于热的纯碱溶液中,充分浸泡后过滤、洗涤。
步骤2:向步骤1的滤渣中加入适量稀硫酸,到剩余少量固体为止。过滤。
步骤3:向步骤2的滤液中加入稍过量的(NH4)2SO4饱和溶液。
步骤4:小火蒸发到有晶膜出现,停止加热,冷却后过滤。
步骤5:将步骤4的滤渣洗涤,干燥,得到产品。
回答下列问题:
(1)步骤1中主要是利用纯碱溶液的碱性除去油污。写出纯碱溶液显碱性的主要的离子方程式:__________________________________ 。
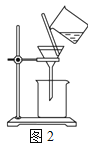
(2)步骤1中,也可以用倾析法代替过滤,操作如图所示。下列适合用倾析法分离的是________
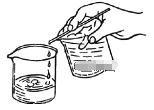
a.沉淀颗粒较大 b.沉淀容易沉降
c.沉淀呈胶状 d.沉淀呈絮状
(3)步骤4不直接蒸干的理由是___________________________________________。
(4)步骤5中,洗涤沉淀用的洗涤剂是_____________。
(二)产品中NH4+、Fe2+的检测。
(5)NH4+的定性检测:取少量产品于试管中,加水溶解,_______________________ ,证明样品中含有NH4+(填操作及现象)。
(6)测定产品中Fe2+的含量:称取10.0g产品,溶于水,加入足量NaOH溶液。过滤、洗涤、灼烧、冷却、称量。重复灼烧、冷却、称量,直到_______________为止。称量固体质量为2.0g。产品中Fe2+的质量分数为_______。
(7)己知Li2Ti5O15和Na2O2中都含有过氧键,Ti的化合价为+4,Na2O2中含有一个过氧键,则Li2Ti5O15中过氧键的数目为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强 ②混合气体的密度③混合气体的总物质的量 ④混合气体的平均相对分子质量 ⑤混合气体的颜色。
(1)一定能证明2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是______(填序号,下同)。
2SO3(g)达到平衡状态的是______(填序号,下同)。
(2)一定能证明 A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是_______。(注:B,C,D均为无色物质)
C(g)+D(g)达到平衡状态的是_______。(注:B,C,D均为无色物质)
II.某温度时,在一个1L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
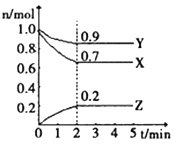
(1)反应开始至2min,以气体Y表示的平均反应速率为________;
(2)该反应的化学方程式为___________;
(3)amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________。
Ⅲ.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图。则电池工作时负极的电极反应式为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如图1所示:
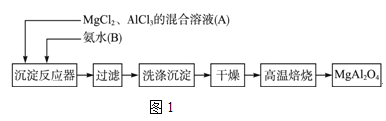
(1)如图2所示,过滤操作中的一处错误是___________。
(2)高温焙烧时,用于盛放固体的仪器名称是_____________。
(3)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
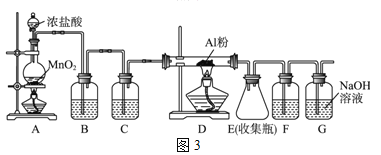
①装置B中盛放饱和NaCl溶液,该装置的主要作用是__________。
②F 中试剂是浓硫酸,若用一件仪器装填适当试剂后也可起到F和G的作用,则该仪器及所装填的试剂为_______。
③装置E的作用是__________。
④制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液中可能有NO3﹣、Cl﹣、I﹣和Fe3﹢中的一种或几种。向该溶液中加入溴水,单质溴被还原,由此推断该溶液中 ( )
A.含有NO3﹣,不含Fe3﹢B.含有NO3﹣、Cl﹣、I﹣
C.含I﹣,但不能确定是否含Cl﹣D.含有Fe3﹢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,在密闭容器中充入1molSO2与2molNO2发生反应:SO2(g)+NO2(g) ![]() SO3(g)+NO(g) △H=-42kJ·mol-1。请回答下列问题。
SO3(g)+NO(g) △H=-42kJ·mol-1。请回答下列问题。
(1)恒温恒容下,在反应平衡体系中再充入一定量SO2,则NO2的平衡转化率__________(填“增大”、“不变”或“减小”,下同);
(2)恒温恒压下,在反应平衡体系中再充入一定量SO2,则NO2的平衡浓度_________;
(3)恒容下,升高温度,上述反应的平衡常数K为_________;
(4)恒容下,降低温度,重新达到平衡时![]() _________。
_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com