
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。

(1)检查装置 A 的气密性方法是:_____。
(2)装置 B 中饱和食盐水的作用是_____;同时装置 B 亦是安全瓶,监测实验进行时 C中是否发生堵塞,请写出发生堵塞时 B 中的现象_____。
(3)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中Ⅰ、Ⅱ、Ⅲ依次放入_____。
A | B | C | D | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(4)设计装置 D、E 的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置 D 中少量溶液加入装置 E 中,振荡,观察到的现象是_____,该现 象_____(填“能”或“不能”)说明溴单质的氧化性强于碘,原因是_____。
【答案】止水夹夹住连接AB之间的橡皮管,向分液漏斗中加水,打开旋塞,水不能连续下滴,说明A 的气密性良好 除去Cl2中的HCl B中长颈漏斗中液面上升,形成水柱,锥形瓶内液面下降 D E中溶液分为两层,上层(苯层)为紫红色 不能 过量的Cl2也可将I﹣氧化为I2
【解析】
由实验装置及题中信息可知,A为氯气发生装置,B可以除去氯气中的HCl,装置 C 的实验目的是验证氯气是否具有漂白性,设计装置 D、E 的目的是比较氯、溴、碘单质的氧化性,F为尾气处理装置。
(1)检查装置A 的气密性方法是止水夹夹住连接AB之间的橡皮管,向分液漏斗中加水,打开旋塞,水不能连续下滴,说明A 的气密性良好;
(2)制备的氯气中含有氯化氢,氯化氢在饱和食盐水中溶解度较大,氯气在饱和食盐水中溶解度不大,所以可以用B中饱和食盐水吸收氯气中的氯化氢;装置 B 亦是安全瓶,监测实验进行时C中是否发生堵塞,若发生堵塞,则B中的压强增大,气体将溶液压入长颈漏斗中,形成水柱,锥形瓶内液面下降;
(3)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性。要验证干燥氯气无漂白性,湿润的有色布条中氯气和水反应生成次氯酸具有漂白性,选项AB的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性;C中干燥剂不能用浓硫酸;D中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,可达实验目的,所以选D;
(4)打开活塞,将装置D中含溴的少量溶液加入含碘化钾和苯的装置E中,溴和碘化钾反应生成碘,碘溶于苯溶液呈紫红色,振荡。观察到的现象是:E中溶液分为两层,上层(苯层)为紫红色。此现象不能说明溴的氧化性大于碘,因为过量的氯气也能把碘离子氧化为碘。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】新型锂-空气电池具有能量密度高的优点,可以用作新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过。下列说法不正确的是

A. 放电时,负极反应式:Li-e- =Li+
B. 应用该电池电镀铜,阴极质量增加64 g,理论上将消耗标准状况下11.2 L O2
C. 放电时,随外电路中电子的转移,水性电解液中离子总数减少
D. Li+穿过固体电解质向正极移动而得到LiOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸的体积有如图所示的关系(不考虑CO2在水中的溶解)。下列说法不正确的是( )
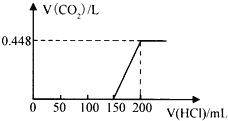
A. 滴加盐酸0→150mL段发生的反应依次为OH-+H+=H2O、CO32-+H+=HCO3-
B. 所用盐酸的物质的量浓度为0.4 molL﹣1
C. CO2体积不再改变时,溶液中的溶质为NaCl
D. 该样品中NaOH与Na2CO3物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素化合物在日常生活、化工生产和环境科学中有着重要的用途。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是______________。
(2)自然界中Cr主要以+3价和+6价形式存在。Cr2O72-中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将Cr2O72-还原。写出反应的离子方程式:___________________________________________。
(3)当皮肤划破时可用FeCl3溶液应急止血,其主要作用是__________________。
(4)高铁酸钾(K2FeO4)是一种既能杀菌、消毒、又能絮凝净水的水处理剂。工业制备高铁酸钾的反应离子方程式Fe(OH)3+ C1O-+ OH-→ FeO42-+ C1-+ H2O(未配平),Fe(OH)3与 C1O-的计量数比为:__________,每生成1mol K2FeO4,转移的电子数是_________。
(5)合成氨及其相关工业中,部分物质间的转化关系如下:

反应IV属于___________反应类型,氮肥主要成分的化学式为_______________,V的化学反应方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,常用Fe2(SO4)3溶液作腐蚀液,腐蚀铜质电路板得到废液主要成分是FeSO4和CuSO4,含少量Fe2(SO4)3。某学习小组设计装置从废液中提取铜,如图所示。已知:Fe2+失电子能力比OH- 强。下列说法正确的是

A. 电解初期阴极没有铜析出,原因是2H++2e-=H2↑
B. 石墨极的电极反应式为2H2O+4e-=4H++O2↑
C. 若电路中转移2mol电子,理论上有2molM从交换膜左侧向右侧迁移
D. 若将废液2充入阳极室时可再生腐蚀液(硫酸铁溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍。该电池反应式为:NaMO2+nC![]() Na(1-x)MO2+NaxCn,下列正确的是
Na(1-x)MO2+NaxCn,下列正确的是

A. 充电时,左侧电极为阳极
B. 电解质可以选用无水乙醇
C. 放电时,负极电极反应时为:NaMO2-xe-=Na(1-x)MO2+xNa+
D. 充电时,阳极电极反应式为:nC+xNa-xe-=NaxCn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀行业中废水处理后产生的含重金属污泥废弃物称为电镀污泥,被列入国家危险废物名单中的第十七类危险废物。工业上可利用某电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金金属,其利用回收流程如下:

已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀的pH | 2.1 | 4.7 | 4.3 |
恰好完全沉淀的pH | 3.2 | 6.7 | a |

(1)浸出过程中的生成物主要是Fe2(SO4)3和_______________(填化学式)
(2)除铁等相关操作:
①加入石灰乳调节pH应满足要求是_______________;
②将浊液加热到80℃,趁热过滤。滤渣Ⅱ的主要成分是______________(填化学式)。
(3)还原步骤中生成Cu2O固体的离子反应方程式______________,此步骤中加入NaHSO3的不能过量______________ (离子方程式表达)。
(4)当离子浓度≤1×10-5mol·L-1时认为沉淀完全,则表格中a的值是______________。(已知:T=25℃,Ksp[Cr(OH)3]=6.3×10-31,![]() ,lg2=0.3)
,lg2=0.3)
(5)将铬块加入到稀盐酸或稀硫酸中,可观察到铬逐渐溶解,同时放出氢气。但若将铬块加稀硝酸中,却看不到明显现象。由此推测,出现该现象的可能原因是____________________________。
(6)处理大量低浓度的含铬废水(以CrO42-计)可采用离子交换法,其原理是采用季胺型强碱性阴离子交换树脂(RN—OH),使庞水中CrO42-与树脂上的OH发生离子交换反应。一段时间后停lh 通废水,再通NaOH溶液时CrO42-进入溶液回收,并使树脂得到再生。请用离子方程式表示该交换过程____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将一铜块浸入500mL某浓度FeCl3溶液中,一段时间后取出,向所得溶液中加入一定量的铁粉,充分反应后有固体剩余。过滤,取出20.0mL滤液,向其中滴入1.20mol/L AgNO3溶液100mL时,溶液恰好完全沉淀。请回答下列有关问题(忽略反应前后溶液体积的变化,计算结果保留三位有效数字):
(1)原FeCl3溶液的物质的量浓度为__________________________。
(2)假若剩余固体中有铁粉,则向溶液中加入的铁粉质量至少大于____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com