
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A.原子半径:r(K)>r(Na))r(Mg)>r(Al)
B.在SiO2晶体中,硅原子数与Si—O键数目之比为1:2
C.在稀溶液中:H+ (aq)+ OH- (aq)==== H2O (1):ΔH=-57.3 kJ/mol,则含1 molCH3COOH的稀溶液和含1 mol NaOH的稀溶液完全反应放出的热量小于57.3kJ
D.1 mol Na2O2固体跟足量CO2气体完全反应,转移2 NA个电子(NA为阿伏加德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
. 下列画有横线的物质在反应中不能完全被消耗的是 ( )
A.将1molCu置于含2molH2SO4的浓硫酸中加热
B.将含少量CO2的CO气体通入盛有足量Na2O2的密闭容器中,并不断用电火花引燃
C.将1 mol Mg置于11.2 L(标准状况)空气中在高温下反应
D.在强光持续照射下,向过量的Ca(ClO)2悬浊液中通入少量CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.原子半径:r(K)>r(Na))r(Mg)>r(Al)
B.在SiO2晶体中,硅原子数与Si—O键数目之比为1:2
C.在稀溶液中:H+ (aq)+ OH- (aq)==== H2O (1):ΔH=-57.3 kJ/mol,则含1 molCH3COOH的稀溶液和含1 mol NaOH的稀溶液完全反应放出的热量小于57.3kJ
D.1 mol Na2O2固体跟足量CO2气体完全反应,转移2 NA个电子(NA为阿伏加德罗常数)
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安徽省濉溪县高三第三次月考化学试卷(解析版) 题型:实验题
某研究性学习小组拟探究在含Mg2+、Al3+ 的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程。
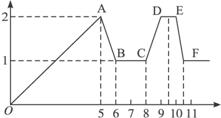
【实验】在0.1 mol∙L-1 MgSO4、0.05 mol∙L-1Al2(SO4)3的混合溶液中滴加0.5 mol∙L-1NaOH溶液,借助氢离子传感器和相应分析软件,测得溶液的pH随NaOH溶液的加入变化情况如图所示。

(1)为精确控制加入NaOH溶液的体积,可将NaOH溶液置于 (填仪器名称)中滴加。
(2)图中有三个pH增加缓慢的阶段,第一阶段(a点前)对应的实验现象是 。
(3)对第二阶段(b、c之间)溶液pH变化缓慢的本质,小组同学做出如下推测,请补充推测2和3:
推测1:生成Mg(OH)2沉淀,消耗OH-;
推测2: ;
推测3: 。
若推测1符合实际情况,则a点之前反应的离子方程式为 ,请据此描述Mg(OH)2、Al(OH)3两种物质在水溶液中溶解性的差异 。
(4)请分析e点后溶液中较大量存在的含金属元素的离子并设计实验检验(可不填满):
|
较大量存在的含金属元素的离子 |
检验方法 |
|
|
|
|
|
|
|
|
|
查看答案和解析>>
科目:高中化学 来源:2011-2012学年重庆市高三上学期期中考试理科综合试题(化学部分) 题型:实验题
(18分)测定SO2转化成SO3的转化率可以用下图装置,装置中烧瓶内发生的化学反应方程式为:Na2SO3(s)+H2SO4(85%)=Na2SO4+H2O+SO2↑。
(已知SO3的熔点是16.8℃,沸点是44.8℃)
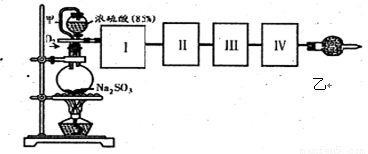
(1)装置中甲管的作用是 ;
乙装置的作用是 。
(2)根据实验需要,应该在I、II、Ⅲ、IV处连接合适的装置,请从下图A~E装置中选择最适合装置并将其序号填放下面的空格中。I、Ⅱ、Ⅲ、Ⅳ处连接的装置分别是 、 、 、 。
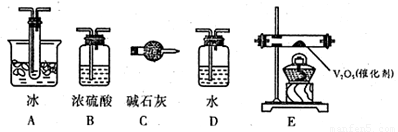
(3)为使SO2有较高的转化率,实验中加热催化剂与滴加浓硫酸的顺序中,应采取的操作是 ,若用大火加热烧瓶时,SO2的转化率会 (填“升高”、“不变”或“降低”)。
(4)将SO2通入含1 mol氯酸的溶液中,可生成一种强酸和一种氧化物,并有6.02×1023个电子转移,则该反应的化学方程式为 。
(5)用nmolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅳ增重了mg,则实验中SO2的转化率为 。(用含m、n的代数式填写)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com