

分析 (1)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,根据构造原理写出亚铁离子核外电子排布式;
(2)根据铁离子的核外电子数,结合能量最低原则、泡利不相容原理和洪特规则,写出核外电子排布式,然后根据3d轨道含有的电子数写出其3d电子的排布情况;
(3)根据“Fe(OH)3在碱性介质中与NaClO反应生成Na2FeO4和NaCl”写出该反应的化学方程式;
(4)根据碳酸钠溶液为碱性溶液,能够除去油污进行分析;
(5)铁屑耗尽,不能防止亚铁离子被氧化;
(6)温度低,晶体的溶解度小.
解答 解:(1)铁是26号元素,铁原子核外有26个电子,铁原子失去2个电子变成亚铁离子,Fe2+在基态时,核外电子排布式为:[Ar]3d6,故答案为:[Ar]3d6;
(2)Fe最外层电子数为26,失去3个电子后,核外电子数变为23,由于先失去最外层电子,可写出铁离子最外层电子排布式为:1s22s22p63s23p63d5,所以3d轨道含有5个电子,根据洪特规则,电子总是优先占据1个轨道,并且自旋方向相同,所以Fe3+的3d电子的排布情况是: ,
,
故答案为: ;
;
(3)Fe(OH)3在碱性介质中与NaClO反应生成Na2FeO4和NaCl,反应的化学方程式为:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O,
故答案为:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3NaCl+5H2O;
(4)Na2CO3溶液显碱性,可以除去铁屑上的油污,升高温度,促进了Na2CO3的水解,溶液碱性增强,去油污能力增强,
故答案为:除去铁屑上的油污.
(5)因亚铁离子易被氧化,加Fe可防止氧化,所以实验步骤②明显不合理,理由是铁耗尽会使亚铁离子被氧化成Fe3+,
故答案为:铁耗尽会使亚铁离子被氧化Fe3+;
(6)温度低,晶体的溶解度小,则少量冰水洗涤,可防止晶体溶解,故答案为:洗涤晶体中混有的稀硫酸,减少洗涤过程中晶体的损耗.
点评 本题考查了核外电子排布式、化学方程式的书写、物质的分离与提纯实验方案设计的评价,题目难度中等,注意掌握化学方程式、核外电子排布式的书写原则,试题有利于提高学生的分析、理解能力.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
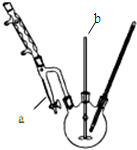
 碘化钠是制备无机和有机碘化物的原料,在医药上用做祛痰剂和利尿剂等.工业上用铁屑还原法制备NaI,其主要流程如图,请回答下列问题:
碘化钠是制备无机和有机碘化物的原料,在医药上用做祛痰剂和利尿剂等.工业上用铁屑还原法制备NaI,其主要流程如图,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 塑化剂DBP(邻苯二甲酸二丁酯)主要应用于PVC等合成材料中作软化剂.反应原理为:
塑化剂DBP(邻苯二甲酸二丁酯)主要应用于PVC等合成材料中作软化剂.反应原理为: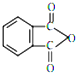 +2CH3CH2CH2CH2OH→
+2CH3CH2CH2CH2OH→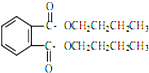 +H2O
+H2O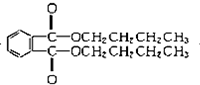 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$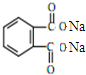 +2CH3CH2CH2CH2OH.
+2CH3CH2CH2CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:3 | B. | 2:1:1 | C. | 4:2:1 | D. | 1:2:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com