
【题目】可用以下方法处理尾气中的SO2。
方法一:活性炭还原法:
反应原理:恒温恒容2C(s)+2SO2(g)![]() S2(g)+2CO2(g)+Q
S2(g)+2CO2(g)+Q
反应进行到不同时间测得各物质的浓度如图:
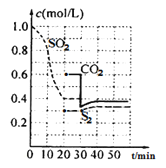
(1)第一次达到平衡的时间是第___min;0~20min化学反应速率表示v(SO2)=___。
(2)30min时平衡发生移动的条件是___。
(3)40min时,平衡常数的计算式为___。(指代入具体数值的算式)
方法二:亚硫酸钠吸收法
(4)Na2SO3溶液吸收SO2的离子方程式为___;
(5)如图是Na2SO3溶液中各离子浓度的相对大小关系示意图。
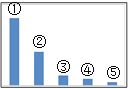
其中③是___。(填微粒符号)
常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是__(填序号)
a.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
b.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
c.水电离出c(OH一)=1×l0-8mol/L
【答案】20 0.03mol/(Lmin) 减小CO2的浓度 ![]() SO32-+SO2+H2O=2HSO3- OH- ac
SO32-+SO2+H2O=2HSO3- OH- ac
【解析】
(1)可逆反应达到平衡时,各组分的浓度保持不变;根据v=![]() 计算二氧化硫的速率;
计算二氧化硫的速率;
(2)30min瞬间,CO2浓度降低,S2的浓度不变,CO2、S2浓度增大,据此分析;
(3)40min的平衡常数和20min时相同,根据K= 计算平衡常数;
计算平衡常数;
(4)Na2SO3溶液与SO2反应生成亚硫酸氢钠;
(5)亚硫酸钠为强碱弱酸盐,SO32-水解使溶液显弱碱性,据此分析作答;
a. 根据电荷守恒判断;
b. 溶液可能是NaHSO3、Na2SO3混合溶液,根据物料守恒进行判断;
c. 水电离出H+的浓度等于溶液中OH-的浓度。
(1)从图中可知20min时各组分的浓度不变,此时反应达到平衡状态;0-20min时,SO2的浓度从1.0mol/L变为0.4mol/L,变化量为0.6mol/L,因此v(SO2)=![]() =
=![]() =0.03mol/(Lmin);
=0.03mol/(Lmin);
(2)30min瞬间,CO2浓度降低,S2的浓度不变,CO2、S2浓度增大,应是减小CO2的浓度形成的;
(3)40min的平衡常数和20min时相同,20min时,SO2的浓度为0.4mol/L,S2的浓度为0.3mol/L,CO2的浓度为0.6mol/L,因此平衡常数K= =
=![]() ;
;
(4)Na2SO3溶液与SO2反应生成亚硫酸氢钠,离子方程式为:SO32-+SO2+H2O=2HSO3-;
(5)亚硫酸钠完全电离生成Na+和SO32-,而SO32-水解生成HSO3-,且HSO3-能继续水解生成H2SO3,最终使溶液呈弱碱性,即c(OH-)>c(H+),因此Na2SO3溶液中各离子浓度的相对大小关系为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),因此图中③是OH-;
a. 根据电荷守恒知:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),因此溶液中c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-),a项正确;
b. 当溶质为NaHSO3时,溶液中S元素以SO32-、HSO3-、H2SO3的形式存在,Na元素与S元素的物质的量之比为1:1,因此溶液中c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),若溶液中存在Na2SO3,则c(Na+)>c(SO32-)+c(HSO3-)+c(H2SO3),b项错误;
c. 水电离出H+的浓度等于溶液中OH-的浓度,由于pH=6,那么水电离出的c(OH-)=![]() =10-8mol/L,c项正确;
=10-8mol/L,c项正确;
答案选ac。


科目:高中化学 来源: 题型:
【题目】不列关于Li、Na、K、Rb、Cs的叙述均正确的一组是( )
①金属性最强的是锂 ②形成的离子中,氧化性最强的是锂离子 ③在自然界中均以化合态形式存在 ④Na在空气中久置后,成分为Na2CO3 ⑤均可与水反应,产物均为MOH和H2 ⑥它们在O2中燃烧的产物都有M2O和M2O2两种形式 ⑦粒子半径:Rb+>K+>Na+,Cs>Cs+
A.①②③④⑤B.③④⑤⑥⑦C.①②④⑥⑦D.②③④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24 L 氟化氢所含分子数为0.1NA
B.常温下,22.4 L 氯气与足量镁粉充分反应,转移的电子数为 2NA
C.丙烯和环丙烷组成的 42 g 混合气体分子中共用电子对总数为 9NA
D.化学反应中每生成 1 mol O2,转移的电子数为 4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物F的合成路线图如图:

已知:HCHO+RCH2CHO![]()
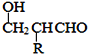
![]()
![]()
请据此回答:
(1)A中含氧官能团名称是________________,C的系统命名为_____________________ 。
(2)检验B中所含官能团所用的试剂有______________、_____________;E→F的反应类型是______________,B+D![]() E的反应类型是______________________。
E的反应类型是______________________。
(3)写出A→B的化学方程式__________________________________________________。
(4)写出C→D的化学方程式__________________________________________________。
(5)参照上述合成路线,设计一条由甲醛、乙醛和甲醇为主要原料制备![]() 的合成路线_______________________________________________________________
的合成路线_______________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是古丝绸之路中的重要贸易商品,下列有关说法错误的是
|
|
|
|
瓷器 | 丝绸 | 茶叶 | 酒 |
A.陶瓷由黏土经高温烧结而成,其主要成分是硅酸盐
B.丝绸的化学成分主要是纤维素,纤维素属于天然有机高分子化合物
C.茶叶中含多种酚类物质,经常饮用可抗氧化、防衰老
D.我国劳动人民很早就掌握了酿酒技术,但自酿酒中可能会含有甲醇等有害物质,不建议直接饮用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水系钠离子电池安全性能好、价格低廉、对环境友好,有着巨大的市场前景。某钠离子电池工作原理如图,电池总反应为:2NaFePO4F + Na3Ti2(PO4)3![]() 2Na2FePO4F+ NaTi2(PO4)3
2Na2FePO4F+ NaTi2(PO4)3
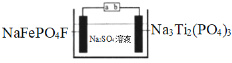
下列说法错误的是
A.充电时,a接电源正极
B.放电时,溶液中的Na+在NaFePO4F电极上得电子被还原
C.充电时,阴极上的电极反应为NaTi2(PO4)3+2Na++2e﹣=Na3Ti2(PO4)3
D.理论上,该电池在充电或放电过程中溶液中的c(Na+)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项正确的是( )
A.NH4HCO3与足量氢氧化钠溶液反应的离子方程式:HCO3-+OH-=CO32-+H2O
B.铁与水蒸气反应的化学方程式:2Fe+3H2O(g)=Fe2O3+3H2
C.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
D.钠和硫酸铜溶液反应的离子方程式:2Na+Cu2+=2Na++Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用Na2O2设计装置验证某些物质的性质。甲组:在试管A中装入足量的固体NaHCO3,D为固定蚊香的硬纸片。试回答下列问题:
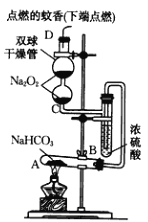
(1)在A试管内发生反应的化学方程式是__。
(2)B装置的作用是__。
(3)在双球干燥管内发生反应的化学方程式__,当有1molNa2O2发生反应,转移电子数目为__;双球干燥管内观察到的实验现象是__。
(4)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com