
(10分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | ② | ③ | | |
| 3 | ④ | | ⑤ | | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | | |
(1)Ar (2)HClO4 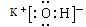 (3)Al Al2O3+2OH-==2AlO2-+H2O
(3)Al Al2O3+2OH-==2AlO2-+H2O
(4)Na2S的形成过程略 离子 (5)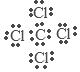 极性
极性
解析试题分析:(1) 根据元素在周期表中的位置及元素性质的关系可知:在这些元素中,化学性质最不活泼的是⑧元素Ar;(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物KOH的电子式是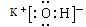 ; (3) 最高价氧化物是两性氧化物的元素是Al;它的氧化物与氢氧化钠反应的离子方程式是Al2O3+2OH-==2AlO2-+H2O;(5)元素①C与⑦元素Cl形成的的化合物CCl4的电子式为
; (3) 最高价氧化物是两性氧化物的元素是Al;它的氧化物与氢氧化钠反应的离子方程式是Al2O3+2OH-==2AlO2-+H2O;(5)元素①C与⑦元素Cl形成的的化合物CCl4的电子式为 ;该化合物是由不同种非金属元素形成的极性键形成的。
;该化合物是由不同种非金属元素形成的极性键形成的。
考点:考查元素周期表、元素周期律的应用的知识。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:单选题
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是
| A.若X+和Y2-的核外电子层结构相同,则原子序数:X > Y |
| B.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S |
| C.硅、锗都位于金属与非金属的交界处,都可以做半导体材料 |
| D.Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH >Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学———化学与技术】
锶(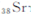 )元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与
)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与
和 同属于第ⅡA族?
同属于第ⅡA族?
(1)碱性:Sr(OH)2 Ba(OH)2(填“>”或“<”);锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是 ?
(2)碳酸锶是最重要的锶化合物?用含SrSO4和少量BaSO4?BaCO3?FeO?Fe2O3?Al2O3?SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和Na2CO3溶液充分混合,过滤;
Ⅱ.将滤渣溶于盐酸,过滤;
Ⅲ.向Ⅱ所得滤液中加入浓硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入次氯酸,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量NH4HCO3,充分反应后,过滤,将沉淀洗净,烘干,得到SrCO3?
已知:ⅰ.相同温度时的溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH 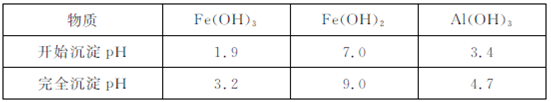
①Ⅰ中,反应的化学方程式是 ?
②Ⅱ中,能与盐酸反应溶解的物质有 ?
③Ⅳ的目的是 ?
④该工艺流程中NH4HCO3含有的化学键是 ?
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分每空1分)
(1)下列3种不同粒子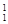 H、
H、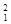 H、
H、 H表示______种元素,______种核素,
H表示______种元素,______种核素,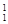 H、
H、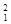 H、
H、 H互称为__________________。
H互称为__________________。
(2)下列各组物质中,互称为同分异构体的是( )
| A.水与冰 | B.O2与O3 |
C.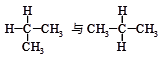 | D. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)Q、W、X、Y、Z均为元素周期表中前四周期元素,且其原子序数依次增大,Q元素的阳离子核外无电子,W元素原子的最外层电子数是其次外层电子数的2倍,Y是地壳中含量最多的元素,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
⑴W位于元素周期表第 周期第 族。Y的第一电离能 (填“大于”或“小于”)X的第一电离能。
⑵XQ3分子中的化学键类型为 (填“极性”或“非极性”)共价键,空间类型为 。Q—X﹑Q—Y﹑Q—W中键长最短的是 。
⑶Z的基态原子核外电子排布式是 ,Z的单质与X的最高价氧化物对应水化物的稀溶液反应的离子方程式为 。
⑷已知:①WQ4(g) +4XY2(g) ﹦4XY(g)+WY2 (g)+2Q2Y(g) △H﹦-574KJ·mol-1
②WQ4(g) +4XY(g) ﹦2X2 (g) +WY2 (g) +2Q2Y(g) △H﹦-1160KJ·mol-1
则由WQ4还原XY2生成X2的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2︰3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题。
(1) X在周期表中的位置是__________________________
(2) 化合物Y2X2的电子式为 _________ ;它含有的化学键类型有 _________
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(3) A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为_____________________________________。
(4) A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则负极电极反应式为_____________________________________。
(5) 写出化合物Y2X2与水反应的离子方程式_____________________。
(6) B的最高价氧化物的结构式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(4分)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
| | | | |||||
| | | | a | | | | |
| | b | | c | | | d | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F、G是原子序数依次增大的短周期元素,其中A与E、D与G同主族,且D与G核内质子数之和是A与E核内质子数之和的2倍,A与B、C、D可分别形成10电子分子,E、F、G元素最高价氧化物对应水化物之间可相互发生反应,请回答下列问题
(1)E、G两种元素的符号:E 、G ;F在元素周期表中的位置是 .
(2)Zn与稀硫酸反应需加入少量硫酸铜溶液反应速率会大大加快,其原理是 。
(3) E在D2中燃烧生成化合物X中阴阳离子个数比为 ;X中的阴离子电子式为 .
(4)能够说明可逆反应2CD2(g) 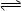 C2D4(g)达到平衡状态的标志是 ;
C2D4(g)达到平衡状态的标志是 ;
①单位时间消耗2mol CD2的同时,生成1 mol C2D4②恒温恒压下,混合气体的密度不变③CD2和C2D4的浓度之比为2∶1 ④混合气体的颜色不变⑤单位时间消耗4mol CD2的同时,消耗2mol C2D4
(5)向含E的最高价氧化物的水化物0.5 mol的水溶液中通入标况下BD2气体11.2L,其化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(18分)在第3周期中,置换酸中氢的能力最强的元素的元素符号为 ,化学性质最稳定的元素符号是 ,最高价氧化物的水化物的酸性最强的化合物的化学式是 ,碱性最强的化合物的化学式是 ,显两性的氢氧化物的化学式是 ,该两性氢氧化物与盐酸、氢氧钠溶液分别反应的离子方程式为 、 ,原子半径最大的金属元素的名称是 ,离子半径最小的离子结构示意图是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com