
| A. | 向试液中滴加氯化钡溶液,产生白色沉淀,则溶液中一定含有CO32- | |
| B. | 向试液中滴加浓氢氧化钠溶液,加热产生刺激性气味的气体,则溶液中一定含有NH4+ | |
| C. | 向试液中滴加硝酸银溶液,产生白色沉淀,则溶液中一定含有Cl- | |
| D. | 向试液中滴加盐酸,产生的气体能使品红溶液褪色,则溶液中一定含有SO32- |
分析 A.白色沉淀可能为AgCl、硫酸钡等;
B.产生刺激性气味的气体为氨气;
C.白色沉淀可能为硫酸银;
D.亚硫酸氢根离子与盐酸反应生成二氧化硫.
解答 解:A.白色沉淀可能为AgCl、硫酸钡等,则溶液中不一定含有CO32-,故A错误;
B.产生刺激性气味的气体为氨气,则溶液中一定含有NH4+,故B正确;
C.白色沉淀可能为硫酸银,则溶液中不一定含有Cl-,故C错误;
D.亚硫酸氢根离子与盐酸反应生成二氧化硫,则溶液中含有SO32-或HSO3-,或都有,故D错误;
故选B.
点评 本题考查常见离子的检验,为高频考点,把握离子检验的试剂、现象及结论为解答本题的关键,侧重分析与实验的考查,注意检验时排除干扰离子,题目难度不大.


 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①②⑤ | C. | ②③⑥ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,36g18O2中所含的中子数为16NA | |
| B. | 1mol乙烯分子中含有共用电子对数为6NA | |
| C. | 电解饱和食盐水时,阳极上生成22.4L气体时转移的电子数为2NA | |
| D. | 标准状况下,2.24LCl2溶于水达到饱和,可得到HClO分子的数目是0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶可防止食物受潮是由于其具有吸水性 | |
| B. | 葡萄糖用于医疗输液是因为它属于强电解质 | |
| C. | Na2CO3可用作食用碱,因为Na2CO3的水溶液显碱性 | |
| D. | 酸性重铬酸钾用于检查酒驾是利用其强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
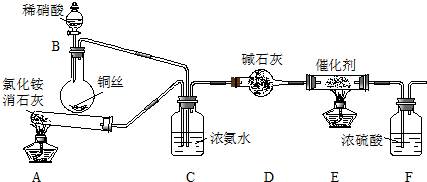
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
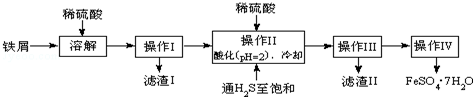
| 25℃时 | pH值 | 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 | FeS开始沉淀 | 3.0 |
| SnS沉淀完全 | 1.6 | FeS沉淀完全 | 5.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com