
| A. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的Ba2+数目为0.05NA | |
| B. | 标准状况下,2.24L CH2Cl2只含有的C-Cl键的数目为0.2NA | |
| C. | 1.8g重水(D2O)只含有NA个中子 | |
| D. | 常温常压下,21g乙烯与环丁烷的混合物中含有原子数目为3NA |
分析 A、25℃时,pH=13的Ba(OH)2溶液中氢氧根离子浓度为0.1mol/L,1L该溶液中含有0.1mol氢氧根离子,而氢氧化钡中氢氧根和钡离子的个数之比为2;1,据此分析;
B、标况下,二氯甲烷为液体;
C、重水的摩尔质量为20g/mol;
D、乙烯和环丁烷的最简式均为CH2.
解答 解:A、25℃时,pH=13的Ba(OH)2溶液中钡离子浓度为0.1mol/L,1.0L溶液中含有0.1mol氢氧根离子,含有的OH-总数为0.1NA,而氢氧化钡中氢氧根和钡离子的个数之比为2;1,故钡离子的个数为0.05NA个,故A正确;
B、标况下,二氯甲烷为液体,不能根据气体摩尔体积来计算其物质的量,故B错误;
C、重水的摩尔质量为20g/mol,故1.8g重水的物质的量为0.09mol,而1mol重水中含10mol中子,故0.09mol重水中含0.9mol中子即0.9NA个,故C错误;
D、乙烯和环丁烷的最简式均为CH2,故21g混合物中含有的CH2的物质的量n=$\frac{21g}{14g/mol}$=1.5mol,故含有4.5mol原子即4.5NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 Ⅱ
Ⅱ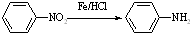 (苯胺,易被氧化)
(苯胺,易被氧化) ;
; +2NaOH→
+2NaOH→ +HCOONa+H2O.
+HCOONa+H2O.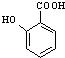 有多种同分异构体,其中含符合下列条件的共有2种.
有多种同分异构体,其中含符合下列条件的共有2种. 的过程.
的过程.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氯化二硫(S2Cl2)在工业上用于橡胶的硫化,它极易与水反应.为在实验室合成S2Cl2,某化学研究性学习小组查阅有关资料,有如下两种反应原理:
二氯化二硫(S2Cl2)在工业上用于橡胶的硫化,它极易与水反应.为在实验室合成S2Cl2,某化学研究性学习小组查阅有关资料,有如下两种反应原理:| 物质 | S | CS2 | CCl4 | S2Cl2 |
| 沸点/℃ | 445 | 47 | 77 | 137 |
| 熔点/℃ | 113 | -109 | -23 | -77 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,可使①②③④反应速率均加快 | |
| B. | △H3=-110.5kJ.mol-1,△H4=+172.5kJ.mol-1 | |
| C. | 反应①②③④均属于化合反应、氧化还原反应 | |
| D. | CO的燃烧热是566.0kJ.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .B与乙醇发生酯化反应生成X的化学方程式为
.B与乙醇发生酯化反应生成X的化学方程式为 +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O.
 经过几步有机反应制得,其中最佳的次序是:a.
经过几步有机反应制得,其中最佳的次序是:a.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应属于置换反应 | B. | 还原性 I2>Cl2 | ||
| C. | 非金属性Cl>I | D. | 氧化性 I2>Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com