
A、按照系统命名法, 的名称为3,3,4-三甲基己烷 的名称为3,3,4-三甲基己烷 |
| B、乙醇、乙酸和乙酸乙酯可以用饱和Na2CO3溶液鉴别 |
| C、苯乙烯中所有原子可能共平面 |
D、1.0mol的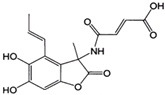 与NaOH溶液和Br2反应时,分别需要消耗NaOH 5.0mol和Br2 3.0mol 与NaOH溶液和Br2反应时,分别需要消耗NaOH 5.0mol和Br2 3.0mol |
 ,该有机物中最长碳链含有6个C,主链为己烷,编号从左上方开始,在2、2、3号C各含有1个甲基,该有机物命名为:2,2,3-三甲基己烷,故A正确;
,该有机物中最长碳链含有6个C,主链为己烷,编号从左上方开始,在2、2、3号C各含有1个甲基,该有机物命名为:2,2,3-三甲基己烷,故A正确;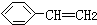 ,苯和乙烯都是平面机构,苯乙烯可以看作乙烯中1个H原子被苯环取代,所以苯乙烯中所有原子可能共平面,故C正确;
,苯和乙烯都是平面机构,苯乙烯可以看作乙烯中1个H原子被苯环取代,所以苯乙烯中所有原子可能共平面,故C正确; 中含有1mol酚羟基的邻位H、2mol碳碳双键,能够消耗3mol溴单质;1mol该有机物中含有2mol酚羟基、1mol酯基、1mol肽键、1mol羧基,其中1mol酯基水解生成1mol酚羟基和1mol羧基,所以1mol该有机物能够消耗6mol氢氧化钠,故D错误;
中含有1mol酚羟基的邻位H、2mol碳碳双键,能够消耗3mol溴单质;1mol该有机物中含有2mol酚羟基、1mol酯基、1mol肽键、1mol羧基,其中1mol酯基水解生成1mol酚羟基和1mol羧基,所以1mol该有机物能够消耗6mol氢氧化钠,故D错误;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
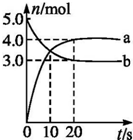 N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在2L固定容积的密闭容器中发生反应2N2O5(g)?4NO2(g)+O2(g)△H>0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示.下列说法中,正确的是( )
N2O5是一种新型硝化剂,其性质和制备受到人们的关注.一定温度下,在2L固定容积的密闭容器中发生反应2N2O5(g)?4NO2(g)+O2(g)△H>0.反应物和部分生成物的物质的量随反应时间变化的曲线如图所示.下列说法中,正确的是( )| A、0~20 s内平均反应速率v(N2O5)=0.1 mol?(L?s)-1 |
| B、10 s时,正、逆反应速率相等,达到平衡 |
| C、20 s时,正反应速率大于逆反应速率 |
| D、曲线a表示NO2的物质的量随反应时间的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在化学反应中,断开反应物中的化学键要吸收能量 |
| B、共价化合物一定含共价键,可能含离子键 |
| C、离子化合物中只含离子键,不含共价键 |
| D、化学反应中的能量变化都表现为热量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3↑+H2O |
| C、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| D、碳酸氢钠溶液中滴入稀盐酸:HCO3-+H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯 | B、乙烷 | C、乙炔 | D、丙烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com