
| A. | 同周期元素中,0族元素的原子半径最小 | |
| B. | 现已发现的ⅡA族元素的单质在常温常压下都是固体 | |
| C. | ⅦA族元素的原子,其半径越大,越容易得到电子 | |
| D. | 所有的主族元素的简单离子所带电荷与其族序数相等 |
分析 A、同周期0族除外从左向右半径逐渐减小;
B、ⅡA族元素为碱土金属,形成的单质常温下都是固体;
C、ⅦA族元素的原子,其半径越大,越容易失电子;
D、阴离子所带电荷数不一定等于其族序数;
解答 解:A、同周期0族除外从左向右半径逐渐减小,所以半径最小的是ⅥⅠA,故A错误;
B、ⅡA族元素为碱土金属,常温下形成的单质都是固态金属单质,故B正确;
C、ⅦA族元素的原子,其半径越大,越容易失电子,而不是得电子,故C错误;
D、阴离子所带电荷数不一定等于其族序数,如:S2-、Cl-,故D错误;
故选B.
点评 本题考查了元素周期表和元素周期律的综合应用,注意各个主族元素性质、状态变化趋势,题目难度不大.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、CO32-、K+、Na+ | B. | Na+、Ba2+、Cl-、HCO3- | ||
| C. | NO3-、Cu2+、K+、SO42- | D. | K+,Na+,Cl-,NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
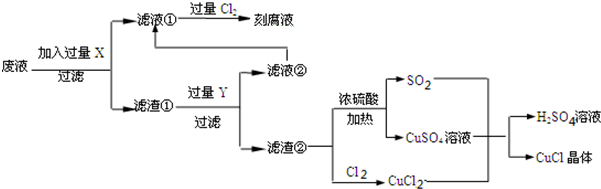
| 1 | 2 | 3 | |
| 空白试验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ③⑤ | C. | ②④⑤ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
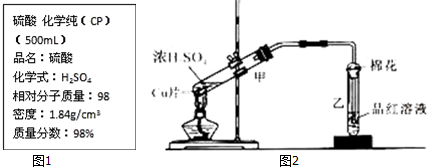
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

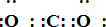 ;写出物质E的电子式:
;写出物质E的电子式: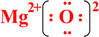 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com