
| A. | 常温下,将铁片置于浓硝酸中:Fe+6HNO3(浓)═Fe(NO3)3+3NO2↑+3H2O | |
| B. | 向氯化铵的稀溶液中加入少量NaOH:NH4++OH-═NH3↑+H2O | |
| C. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-═BaSO4↓ | |
| D. | 向浓硝酸中加入铜片:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O |
分析 A.常温下,将铁片置于浓硝酸中,发生钝化;
B.反应生成一水合氨;
C.漏写铵根离子与碱的反应;
D.发生氧化还原反应,生成硝酸铜、二氧化氮和水.
解答 解:A.常温下,将铁片置于浓硝酸中,发生钝化,生成致密的氧化膜阻止反应的进一步进行,不能写离子反应,故A错误;
B.向氯化铵的稀溶液中加入少量NaOH的离子反应为NH4++OH-═NH3.H2O,故B错误;
C.向(NH4)2SO4溶液中加入适量Ba(OH)2的离子反应为2NH4++2OH-+Ba2++SO42-═BaSO4↓+2NH3.H2O,故C错误;
D.向浓硝酸中加入铜片的离子反应为Cu+4H++2NO3-═Cu2++2NO2↑+2H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,选项A为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
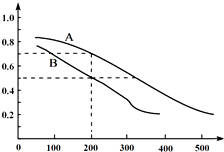
| A. | 分别对两溶液微热时,K均增大、溶液pH均减小 | |
| B. | 恒温下分别稀释两溶液时,K均不变、溶液pH均增大 | |
| C. | 25℃时a+b=14 | |
| D. | 25℃时两溶液混合所得pH=8的溶液中,c(X-)>c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 半导体材料砷化镓 | B. | 透明陶瓷材料硒化锌 | ||
| C. | 吸氢材料镧镍合金 | D. | 超导材料K3C60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有:
科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2.“气化炉”中主要反应有:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
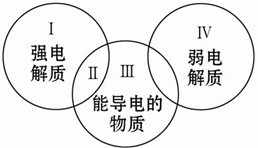 对下列物质:①镁 ②石墨 ③熔融氯化钠 ④盐酸 ⑤稀硫酸 ⑥氨水 ⑦白磷 ⑧硫酸钡 ⑨冰醋酸 ⑩二氧化碳,分类正确的是( )
对下列物质:①镁 ②石墨 ③熔融氯化钠 ④盐酸 ⑤稀硫酸 ⑥氨水 ⑦白磷 ⑧硫酸钡 ⑨冰醋酸 ⑩二氧化碳,分类正确的是( )| A. | Ⅰ包含的物质有③④⑤⑧ | B. | Ⅱ中包含的物质是③ | ||
| C. | Ⅲ中包含的物质是①②③⑤⑥⑧ | D. | Ⅳ中包含的物质是⑥⑨⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 或
或 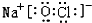 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com