
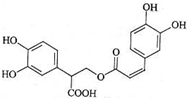
| A. | 迷迭香酸属于芳香烃 | |
| B. | 1mol迷迭香酸最多能和9mol氢气发生加成反应 | |
| C. | 迷迭香酸可以发生水解反应、消去反应和酯化反应 | |
| D. | 1mol迷迭香酸最多能和含6 mol NaOH的水溶液完全反应 |
分析 有机物含有O元素,为烃的含氧衍生物,含有酚羟基,可发生取代、氧化和显色反应,含有羧基,具有酸性,可发生中和、酯化反应,含有酯基,可发生水解反应,含有碳碳双键,可发生加成、加聚和氧化反应,以此解答该题.
解答 解:A.有机物中只含碳氢两种元素的化合物称烃,迷迭香酸分子中含有氧元素,所以迷迭香酸不属于芳香烃,为烃的含氧衍生物,故A错误;
B.该分子中含有苯环、碳碳双键,所以在一定条件下能与氢气发生加成反应,1mol迷迭香酸含有2mol苯环,2mol苯环需要6mol氢气发生加成反应,1mol迷迭香酸含有1mol碳碳双键,1mol碳碳双键需要1mol氢气发生加成反应,所以最多能和7mol氢气发生加成反应,故B错误;
C.因含有羧基,所以能与醇发生酯化反应;因含有酯基,所以能发生水解反应,但不能发生消去反应,故C错误;
D.1mol迷迭香酸含有4mol酚羟基、1mol羧基、1mol酯基,4mol酚羟基需要4mol氢氧化钠与其反应,1mol羧基需要1mol氢氧化钠与其反应,1mol酯基需要1mol氢氧化钠与其反应,所以1mol迷迭香酸最多能和含6molNaOH的水溶液完全反应,故D正确.
故选D.
点评 本题考查有机物的结构和性质,注意把握有机物官能团的性质,为解答该题的关键,易错点为B,注意羧基中C=O不能发生加成反应,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ax/100bmol/L | B. | ax/500bmol/L | C. | ax/2000bmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 | |
| B. | 苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯 | |
| C. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| D. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在2L水中溶有80克的NaOH | B. | 80克NaOH溶于2L水配成的溶液 | ||
| C. | 每升溶液中含有80克NaOH | D. | 每2L溶液中含有80克NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 H2O2$\frac{\underline{\;催化剂\;}}{\;}$2 H2O+O2↑ | B. | 2 Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3 H2O | ||
| C. | Fe2O3+3 CO$\frac{\underline{\;高温\;}}{\;}$2 Fe+3 CO2 | D. | Cl2+H2O═HCl+HclO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;NH3的稳定性比PH3的强(填“强”或“弱”).
;NH3的稳定性比PH3的强(填“强”或“弱”).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com