
| A. | 1s12s1 | B. | 1s22s12p1 | C. | 1s22s22p63s2 | D. | 1s22s22p63p1 |
分析 符合能量最低原理、泡利原理和洪特规则的核外电子排布式是基态原子电子排布式.
解答 解:①基态原子的电子排布式应为1s2,发生电子跃迁为1s12s1,故A错误;
②基态原子的电子排布式应为1s22s2,发生电子跃迁为1s22s12p1,所以不是基态原子电子排布式,故B错误;
③基态原子的电子排布式为1s22s22p63s2,符合基态原子电子排布规律,故C正确;
④基态原子的电子排布式为1s22s22p63s1,发生电子跃迁为1s22s22p63p1,故D错误;
故选C.
点评 本题考查了原子核外电子排布,根据基态原子排布规律来分析解答即可,难度不大,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届贵州省高三上第四次模拟化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W的原子序数依次增大。它们分别位于不同的主族,X 的最高正价与最低负价代数和为0, Y为金属元素,Y与Z最外层电子数之和与W的最外层电子数相等,X与W所在族序数之和等于10。下列说法正确的是
A. 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) B. 沸点:XW2>Y2W
C. 最高价氧化物对应的水化物的酸性:X>Z D. 简单氢化物的热稳定性:Z<W
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上第一次月考化学卷(解析版) 题型:选择题
下列有关方程式书写正确的是
A.FeCl2溶液中加入氯水的离子方程式:Fe2++ Cl2=Fe3++2Cl-
B.食醋与NaOH反应的离子方程式:H++OH-=H2O
C.CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
D.Na2O2与水反应的离子方程式:2O22-+ 2H2O = 4OH-+ O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
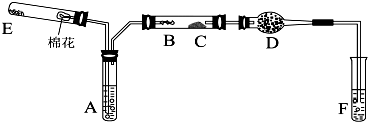
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3的水解:SO32-+2H2O?H2SO3+2OH- | |
| B. | NaHCO3的电离:NaHCO3?Na ++H++CO32- | |
| C. | 钢铁发生吸氧腐蚀的负极反应式:4OH-+4e-=H2O+O2↑ | |
| D. | 用惰性电极电解饱和食盐水时,阳极的电极反应式:2Cl--2e-=Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示.
已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和2-甲基-2-戊烯无论以什么比例混合,只要总质量一定,完全燃烧后生成CO2的质量就一定 | |
| B. | 乙烯和环丁烷(C4H8)分子间相差两个CH2原子团,故它们互为同系物 | |
| C. | 1 mol 乙烯与Cl2完全加成后再与Cl2发生最大程度的取代,两个过程共需Cl26 mol | |
| D. | 以乙烯为原料制备的聚乙烯可以使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用容量瓶配某盐溶液,定容摇匀后发现凹液面最低处低于刻度线,再加水定容 | |
| B. | 萃取后,分液漏斗中的下层液体从下口流出,上层液体从上口倒出 | |
| C. | 向某溶液中加入KSCN溶液变红色,说明该溶液中含有Fe3+ | |
| D. | 某气体通入品红溶液中,溶液褪色,加热后溶液又恢复为红色,说明该气体为SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com