
【题目】填表
微粒 | 核外电子数 | 中子数 | 质量数 | 最外层电子数 |
| __________ | ____________ | _________ | _________ |
| _________ | ___________ | _________ | ____________ |
| ___________ | ________ | ______ | ________ |
【答案】17 20 37 7 13 14 27 3 18 18 34 8
【解析】
根据元素符号各个角标的含义:左下角表示原子序数,左上角表示质量数,右上角表示微粒带有的电荷数目及电性,根据微粒数目关系:原子序数=原子核内质子数=原子核外电子数,阴离子核外电子数=原子核外电子数+离子带有的电荷数目,根据原子核外电子排布特点,推断出各种微粒的具体数值。
(1)![]() Cl:质子数:17,核外电子数:17;中子数=37-17=20;质量数:37;Cl原子核外电子排布式是2、8、7,可见其最外层电子数:7;
Cl:质子数:17,核外电子数:17;中子数=37-17=20;质量数:37;Cl原子核外电子排布式是2、8、7,可见其最外层电子数:7;
(2)![]() Al:质子数:13,核外电子数:13;中子数=27-13=14;质量数:27;Al原子核外电子排布式是2、8、3,可见其最外层电子数:3;
Al:质子数:13,核外电子数:13;中子数=27-13=14;质量数:27;Al原子核外电子排布式是2、8、3,可见其最外层电子数:3;
(3)![]() S2-:质子数:16,核外电子数:16+2=18;中子数=34-16=18;质量数:34;S2-核外电子排布式是2、8、8,可见其最外层电子数:8。
S2-:质子数:16,核外电子数:16+2=18;中子数=34-16=18;质量数:34;S2-核外电子排布式是2、8、8,可见其最外层电子数:8。


科目:高中化学 来源: 题型:
【题目】下列性质比较结果错误的是( )
A.碳碳键键长:乙烯>苯B.沸点:正戊烷>异戊烷
C.相对密度: ![]() >
> ![]() D.水溶性:CH3CH2OH>CH3CH2Br
D.水溶性:CH3CH2OH>CH3CH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种药物合成中间体,其合成路线如图:
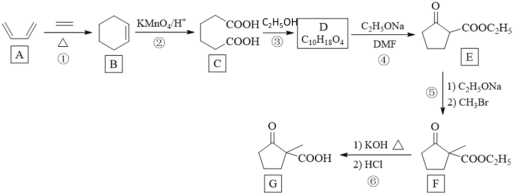
已知:R1CH2COOCH2CH3+R2COOCH2CH3![]()
![]() +CH3CH2OH
+CH3CH2OH
(1)化合物A的名称是_____。
(2)反应②和⑤的反应类型分别是_____、_____。
(3)写出C到D的反应方程式_____。
(4)E的分子式_____。
(5)F中官能团的名称是_____。
(6)X是G的同分异构体,X具有五元碳环结构,其核磁共振氢谱显示四组峰,且峰面积之比为6:2:1:1。写出两种符合要求的X的结构简式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对拟卤素的性质进行探究,设计了以下实验( )
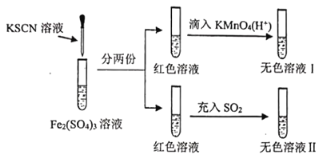
已知:(CN)2、(SCN)2、(OCN)2等称之为拟卤素,它们的化学性质均与卤素单质相似。下列说法正确的是( )
A.溶液颜色变红时发生反应的离子方程式是:Fe3++3SCN-=Fe(SCN)3↓
B.红色溶液褪色表现了的漂白性
C.氧化性:KMnO4>Fe3+>(SCN)2
D.无色溶液Ⅱ中滴入适量的KMnO4(H+)溶液,溶液又变成红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用KIO3与H2S反应制备KI固体,装置如图所示。实验步骤:①检查装置的气密性;②关闭K,在各装置中加入相应试剂,向装置B中滴入30%的KOH溶液,制得KIO3;③打开K,通入H2S直至饱和可制得KI,同时有黄色沉淀生成;④关闭K,向所得溶液滴入稀硫酸,水浴加热,充分逸出H2S;⑤把装置B中混合液倒入烧杯,为除去硫酸,加入足量碳酸钡,再经过一系列操作可得成品。下列有关该实验的叙述错误的是( )
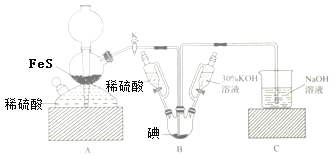
A.步骤②可观察到固体溶解,溶液由棕黄色变为无色
B.步骤③装置B中发生反应的离子方程式为3H2S+IO3-═3S↓+3H2O+I-
C.装置C中氢氧化钠溶液的作用是吸收硫化氢
D.步骤⑤中一系列操作为过滤,洗涤,合并滤液和洗液,蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是
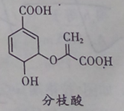
A.分子中含有2种官能团
B.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可与乙醇、乙酸反应,且反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法不正确的是( )
A.0.1mol/L的FeCl3溶液与0.01mol/L的FeCl3溶液中,Fe3+的浓度之比大于10
B.将a mol·L-1的氨水与0.01mol·L-1的盐酸等体积混合后,c(NH4+)=c(Cl-),则NH3·H2O的电离常数为![]()
C.pH加和为12的强酸与弱酸混合,pH可能为6
D.0.1mol·L-1 NH4HS溶液中有:c(NH4+)=c(HS-)+c(S2-)+c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土资源素有“工业维生素”“新材料之母”之称,我国稀土储量世界第一。已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应(注:铈常见的化合价为![]() 和
和![]() ,氧化性:
,氧化性:![]() )。下列说法正确的是( )
)。下列说法正确的是( )
A.铈溶于氢碘酸的化学方程式可表示为:![]()
B.![]() 溶液与硫酸铁溶液混合,其离子方程式为:
溶液与硫酸铁溶液混合,其离子方程式为:![]()
C.铈元素如果要排在金属活动性顺序表中,其位置应靠近![]() 元素
元素
D.金属![]() 保存时可以用水封来隔绝空气,防止被氧化
保存时可以用水封来隔绝空气,防止被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将2molSO2和1molO2冲入10L恒温密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g)ΔH═-196kJ/mol,5min时达到平衡,测得反应放热166.6kJ。下列说法错误的是( )
A.0~5min内,用O2表示的平均反应速率υ(O2)═0.017mol·(L·min)-1
B.条件不变,起始时向容器中冲入4molSO2和2molO2,平衡时反应放热小于333.2kJ
C.若增大O2的浓度,则SO2的转化率增大
D.![]() 的值不变时,该反应达到平衡状态
的值不变时,该反应达到平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com