
| A. | 都能使溶液的pH增加 | |
| B. | 都能使溶液的导电性增强 | |
| C. | 溶液中c(H+)•c(OH-)增大 | |
| D. | 都能使溶液中$\frac{c(CHCO{O}^{-})}{c(CHCOO{H}^{+})}$比值减小 |
分析 CH3COOH溶液加水稀释,平衡向正反应方向移动,电离程度增大,由于溶液体积增大,所以溶液中c(H+)和c(CH3COO-)减小,溶液的pH增大,导电能力减弱;CH3COOH溶液加入少量CH3COONa晶体时平衡向逆反应方向移动,电离程度减小,溶液的PH增大,导电能力增强,溶液中c(H+)减小,温度不变,水的离子积常数和电离平衡常数不变.
解答 解:A、CH3COOH溶液加水稀释,平衡向正反应方向移动,电离程度增大,由于溶液体积增大,所以溶液中c(H+)减小,溶液的pH增大,故A正确;
B、CH3COOH溶液加水稀释,体积增大,c(H+)和c(CH3COO-)都减小,所以溶液的导电性减弱,故B错误;
C、溶液中Kw=c(H+)•c(OH-)是个定值,只受温度影响,所以c(H+)•c(OH-)不变,故C错误;
D、CH3COOH溶液加水稀释,平衡向正反应方向移动,电离程度增大,则n(CH3COO-)增大,n(CH3COOH)减小,所以溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$比值增大;CH3COOH溶液中加入CH3COONa,则n(CH3COO-)增大,所以溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$比值增大,故D错误;
故选A.
点评 本题考查外界条件对水解平衡的影响,重点考查离子浓度以及同离子效应对电离平衡的影响,注意总结影响因素以及平衡移动的方向的判断,题目难度不大.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1L水中含有1molH2SO4 | B. | 1L溶液中含有1molH+ | ||
| C. | 1LH2SO4溶液中含98g H2SO4 | D. | 将98g H2SO4溶于1L水配成溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
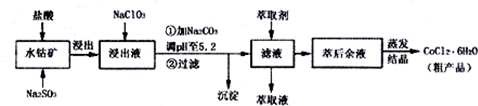
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
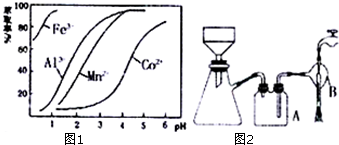
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
| A. | 该反应的正反应是吸热反应 | |
| B. | 100℃时,向体积为V1L的恒容密闭容器中充入2mol CO和4mol H2,达到平衡时,CO的转化率为40%,则V1=12 | |
| C. | 250℃时,向体积为V2L的恒容密闭容器中充入3mol CO和3mol H2,达到平衡时,混合气体中CO的体积分数为50% | |
| D. | 250℃时,向体积为V2L的恒容密闭容器中充入3mol CO和3mol H2,达到平衡时,混合气体中CH3OH(g)的体积分数为62.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCN | B. | CH3COOH | C. | HF | D. | HNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应的化学方程式为5A+4B?4C | |
| B. | 2min时,该反应达到平衡,此时A、B、C的浓度比为5:4:4 | |
| C. | 用B的浓度变化表示0-2min时间内的速率为2mol/(L•min) | |
| D. | 2min前,正反应速率逐渐减小,逆反应速率逐渐增大,但是正反应速率大于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高一定的温度 | |
| B. | 加入100 mL 0.1 mol•L-1的醋酸溶液 | |
| C. | 加入少量的0.5 mol•L-1的硫酸 | |
| D. | 加入少量的1 mol•L-1的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com