
工业制硫酸生产流程如下图:
|

(1)在沸腾炉中,需要将黄铁矿粉碎的目的是 。
(2)在催化反应室,下列措施中有利于提高SO2平衡转化率的有 。(填写编号)
a.减少压强 b.升高温度 c.不断补充空气 d.及时分离出SO3
(3)在生产中,为提高催化剂效率采取的措施有 , (答出2点)。
(4)在450℃、常压和钒催化条件下,在容积为VL的恒容容器中加入2n molSO2和n molO2
判断反应达到平衡状态的标志是 。(填写编号)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
反应达若平衡后测得平衡常数为K,此时O2的转化率为x,则K和x的关系满足K= 。
(5)图1、2表示该SO2和O2的反应在时刻t1达到平衡、在时刻t2因改变某个条件而发生变化的情况:
① 图1中时刻t2发生改变的条件是 。
② 图2中时刻t2发生改变的条件是 。

科目:高中化学 来源: 题型:
在常温下,把一个盛有一定量甲烷和氯气的密闭玻璃容器放在光亮的地方,两种气体发生反应,下列叙述不正确的是
A.容器内压强不变 B. 容器内分子总数不变
C.容器内原子总数不变 D. 容器内发生的反应是取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
从海水提取溴的过程中,吸收塔内溴蒸气和吸收剂SO2发生的化学反应为:
Br2 + SO2 + 2H2O == 2HBr + H2SO4,下列说法正确的是 ( )
A.Br2在反应中表现还原性 B.SO2在反应中被还原
C.Br2在反应中失去电子 D.1mol氧化剂在反应中得到2mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下0.1 mol·L-1氨水的pH=a,下列能使溶液pH=(a+1)的措施是
A.加入适量的氢氧化钠固体 B.将溶液稀释到原体积的 10倍
C.加入等体积0.2 mol·L-1氨水 D.降低溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
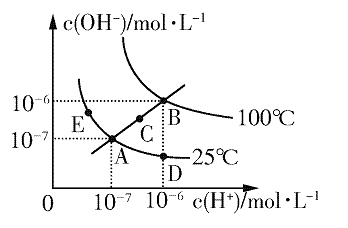
水的电离平衡曲线如图所示,下列说法正确的是
A.图中五点KW间的关系:B>C>A=D=E
B.若从D点到A点,可采用在水中加入少量酸的方法
C.若从A点到C点,可采用温度不变时在水中加入适量NaOH固体的方法
D.若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
向某无色溶液中分别进行下列操作,所得现象和结论正确的是( )
A.加入氨水,产生白色沉淀,证明原溶液中存在Al3+
B.加入AgNO3溶液,产生白色沉淀,证明原溶液中存在Cl-
C.加入盐酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中存在SO
D.加入NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,证明原溶液中存在NH
查看答案和解析>>
科目:高中化学 来源: 题型:
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。有关说法不正确的是( )
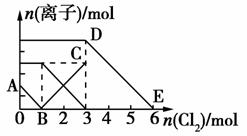
A.线段BC代表Fe3+物质的量的变化情况
B.原混合溶液中n(FeBr2)=3 mol
C.当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
D.原溶液中n(Fe2+):n(I-):n(Br-)=3:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、质量数为293的超重元素,该元素原子核内的中子数与核外电子数之差为
A.47 B.57
C.61 D.175
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com