
【题目】工业上利用Ga与NH3高温条件下合成固体半导体材料氮化稼(GaN)同时有氢气生成。反应中,每生成3molH2时放出30.8kJ的热量。恒温恒容密闭体系内进行上述反应, 下列有关表达正确的是
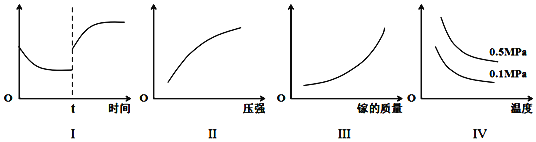
A. I图像中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压
B. II图像中纵坐标可以为镓的转化率
C. III图像中纵坐标可以为化学反应速率
D. IV图像中纵坐标可以为体系内混合气体平均相对分子质量
科目:高中化学 来源: 题型:
【题目】有反应:Fe2O3+2Al![]() Al2O3+2Fe。
Al2O3+2Fe。
(1)________元素的化合价升高,则该元素的原子________电子,被________(填“氧化”或“还原”);而________元素的化合价降低,则该元素的原子________电子,被________(填“氧化”或“还原”)。
(2)该反应中Fe2O3发生了________反应,Al发生了________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100mol·L-1的NaOH溶液分别滴定均为20.00mL0.100mol·L-1的HCl溶液和醋酸溶液,滴定曲线如图所示。下列说法正确的是

A. I表示的是滴定醋酸的曲线
B. pH =7时,滴定醋酸消耗的V(NaOH)>20.00mL
C. V(NaOH)= 20.00mL时,两份溶液中c(Cl-)>c(CH3COO-)
D. V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾K4Fe(CN)6俗名黄血盐,可溶于水,不溶于乙醇。以某电镀厂排放的含NaCN度液为主要原料制备黄血盐的流程如下:
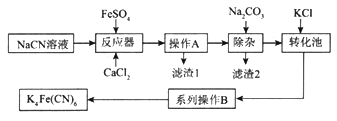
请回答下列问题:
(1)常温下,HCN的电离常数Ka=6.2×10-10。
①实验室配制一定浓度的NaCN溶液时,将NaCN溶解于一定浓度的NaOH溶液中,加水稀释至指定浓度,其操作的目的是__________________________。
②浓度均为0.5mol/L的NaCN和HCN的混合溶液显______(填“酸”“碱”或“中”)性,通过计算说明:_________________________。
(2)转化池中发生复分解反应生成K4Fe(CN)6,说明该反应能发生的理由:__________。
(3)系列操作B为_____________________。
(4)实验室中,K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗可溶性盐Tl2SO4中毒,得到K2SO4及另外一种复杂难溶物,试写出上述治疗Tl2SO4中毒的离子方程式:______________________。
(5)一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3Fe(CN)6和亚铁氰化钾K4Fe(CN)6的混合溶液。
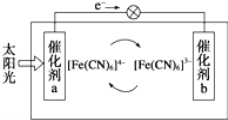
①K+移向催化剂___________(填“a”或“b”)。
②催化剂a表面发生的反应为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B为常见的非金属单质且常温下均为气体,甲、乙为金属单质,乙在I的浓溶液中发生钝化,C为极易溶于水的气体而且水溶液呈碱性,而H为一种强碱,各物质间的转化关系如下图(部分生成物末给出,且未注明反应条件):

(1)已知D为无色气体遇氧气随即变为红棕色气体G,则上述转化关系的反应④中,每反应消耗3mol G,转移电子的物质的量为___________mol。
(2)实验室制取C物质的化学方程式为:__________________。
(3)已知上述转化关系中反应⑥的发生一般是将H溶于水得到强碱溶液再与金属乙混合,此时看到金属乙溶解且表面冒气泡,请写出反应⑥的离子方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入稀有气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入稀有气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入稀有气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入稀有气体,能提高COCl2转化率的是( )
A. ①②④ B. ①④⑥ C. ②③⑤ D. ③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,二元弱酸H2X溶液中含X微粒的分布分数如图所示。下列叙述正确的是
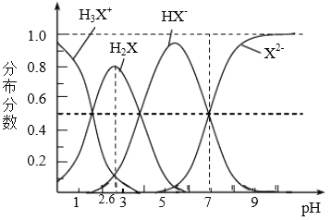
A. 溶液pH由l升至2.6时主要存在的反应是:H3X++OH-=H2X+H20
B. H2X的第二步电离平衡常数Ka2(H2X)为10-4
C. NaHX溶液中c(H+)<c(OH-)
D. 当溶液呈中性时:c(Na+)=2c(X2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 节日里燃放的五彩缤纷的烟花是某些金属元素化学性质的展现
B. 将等物质的量的氧化钠和过氧化钠分别投入到足量且等质量的水中,得到溶质质量分数分别是 a%和 b%的两种溶液,则a 和 b 的关系是 a=b
C. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来, 说明金属铝的熔点较低
D. 用如图装置进行实验,将装置①中的 AlCl3 溶液滴入装置②浓氢氧化钠溶液,溶液中可观察到有大量白色沉淀产生

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量的Na2CO3和NaHCO3固体混合物加热至无气体放出为止,称得加热后剩余固体质量比原来减少了6.2 g,现再取同样质量的原固体混合物与过量的盐酸反应,生成15.68 L CO2(标准状况)。请计算:
(1)加热后剩余固体物质的成分是什么_________?
(2)混合物中Na2CO3和NaHCO3的物质的量分别是多少______________?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com