
【题目】氮化钠(Na3N)和叠氮酸钠(NaN3)是氮和钠的两种重要化合物。Na3N能与水反应: ![]() 。
。
(1)写出该反应产物中属于离子化合物的电子式:_______________。
(2)写出Na3N与足量盐酸反应的化学方程式:______________________________________。
(3)将该反应中四种元素的简单离子按离子半径由大到小的顺序排列:___________________。
(4)该反应四种元素中的三种,能组成一种在水溶液中显酸性的盐,写出该盐的化学式:______。
(5)O元素的非金属性比N元素强,请用一个事实说明:____________________________。
(6)叠氮酸钠(NaN3)受撞击会分解: ![]() ,故NaN3可应用于汽车安全气囊,若产生67.2L(标准状况下)氮气,则该反应中转移电子______________个。
,故NaN3可应用于汽车安全气囊,若产生67.2L(标准状况下)氮气,则该反应中转移电子______________个。
(7)叠氮酸(HN3)是弱酸,酸性与醋酸相似,写出HN3的电离方程式:___________________;将NaN3水溶液中的离子按浓度由大到小排序:__________________________________。
【答案】 ![]() Na3N+4HCl=3NaCl+NH4Cl N3->O2->Na+>H+ NH4Cl H2O的热稳定性比NH3强等,合理即可 2NA HN3
Na3N+4HCl=3NaCl+NH4Cl N3->O2->Na+>H+ NH4Cl H2O的热稳定性比NH3强等,合理即可 2NA HN3![]() H++N3- c(Na+)>c(N3-)>c(OH-)>c(H+)
H++N3- c(Na+)>c(N3-)>c(OH-)>c(H+)
【解析】(1)该反应产物中![]() 是离子化合物而
是离子化合物而![]() ,所以
,所以![]() 的电子式为
的电子式为![]() (2)Na3N与盐酸反应生成氯化钠和氯化铵,反应的化学方程式为, Na3N+4HCl=3NaCl+NH4Cl因此,本题正确答案是:Na3N+4HCl=3NaCl+NH4Cl (3)反应中四种元素的简单离子分别为:N3-、O2-、Na+、H+其中H+的半径最小,N3-、O2-、Na+三种离子的电子层结构相同,根据核电荷数越大半径越小可得N3->O2->Na+。所以四种离子半径的大小顺序为:N3->O2->Na+>H+(4)由盐的水溶液显酸性可知不能是钠盐,只能是一种强酸弱碱盐即铵盐,可是此盐为氯化铵NH4Cl (5)O元素的非金属性比N元素强可从H2O的热稳定性比NH3强等方面来考虑。(6)2mol叠氮酸钠反应生成2mo钠和3mol氮气转移2mol电子。若产生67.2L(标准状况下)氮气,即3mol,则该反应中转移电子2mol即2NA个。(7)叠氮酸(HN3)是弱酸,在溶液中不能全部电离,电离方程式为HN3
(2)Na3N与盐酸反应生成氯化钠和氯化铵,反应的化学方程式为, Na3N+4HCl=3NaCl+NH4Cl因此,本题正确答案是:Na3N+4HCl=3NaCl+NH4Cl (3)反应中四种元素的简单离子分别为:N3-、O2-、Na+、H+其中H+的半径最小,N3-、O2-、Na+三种离子的电子层结构相同,根据核电荷数越大半径越小可得N3->O2->Na+。所以四种离子半径的大小顺序为:N3->O2->Na+>H+(4)由盐的水溶液显酸性可知不能是钠盐,只能是一种强酸弱碱盐即铵盐,可是此盐为氯化铵NH4Cl (5)O元素的非金属性比N元素强可从H2O的热稳定性比NH3强等方面来考虑。(6)2mol叠氮酸钠反应生成2mo钠和3mol氮气转移2mol电子。若产生67.2L(标准状况下)氮气,即3mol,则该反应中转移电子2mol即2NA个。(7)叠氮酸(HN3)是弱酸,在溶液中不能全部电离,电离方程式为HN3![]() H++N3-。NaN3水溶液中N3-要水解,离子浓度减小,使溶液显碱性所以c(Na+)>c(N3-)>c(OH-)>c(H+)
H++N3-。NaN3水溶液中N3-要水解,离子浓度减小,使溶液显碱性所以c(Na+)>c(N3-)>c(OH-)>c(H+)


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下图是中学化学中常用于泡合物的分离和提纯装置,请根据装置回答问题:
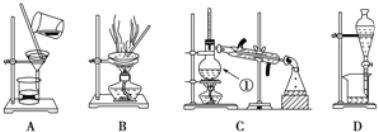
(1)在装置A和装置B中都用到玻璃棒,装置A中玻璃棒的作用是_____,装置B中玻璃棒的作用是_________。
(2)装置C中①的名称是_____,此装置中冷凝水进出方向是_____。装置D中的分液漏斗在使用之前应该_____,在分液时为使液体顺利滴下,应进行的具体操作是_______。
(3)某硝酸钠固体中混有少量硫酸钠杂质,现设计一实验方案,既除去杂质,又配成硝酸钠溶液。
实验方案:先将固体溶于蒸馏水配成溶液,选择合适的试剂和操作完成表格中各步实验。
选择试剂 | ① | Na2CO3溶液 | ④ |
实验操作 | ② | ③ | 加热 |
所加入的试剂①可以是_____(填化学式),证明溶液中SO42-已经除尽的方法是______。加入Na2CO3溶液的目的是_____,所加入的试剂④可以是_____(填化学式)。
(4)青蒿素是高效的抗疟疾药,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156-157℃,热稳定性差。已知:乙醚沸点为35℃。提取青蒿素的主要工艺为:

若要在实验室模拟上述工艺,操作I选择的装置是_____(填代号),操作Ⅱ的名称是_____,选择的装置是_____(填代号),为防止暴沸,粗品中需要加入_____。操作Ⅲ的主要过程可能是_____(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶、过滤
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列图像描述正确的是( )

A. 图①可表示将氨气通入醋酸溶液至过量过程中溶液导电性的变化
B. 根据图②可判断可逆反应A2(g)+3B2(g)![]() 2AB3(g)的ΔH>0
2AB3(g)的ΔH>0
C. 图③表示等体积、等pH的盐酸与醋酸溶液分别与足量的镁粉发生反应产生氢气的体积(V)随时的变化的示意图
D. 图④表示压强对可逆反应A(g)+B(g)![]() 2C(g)+D(g)的影响,乙的压强大
2C(g)+D(g)的影响,乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用碳酸钠晶体(Na2CO3·10H2O)配制0.2 mol·L-1的Na2CO3溶液480 mL。
(1)本实验用到的仪器除托盘天平、烧杯、玻璃棒、胶头滴管外还需要______________,应称取Na2CO3·10H2O晶体的质量为________克。
(2)下列操作中,容量瓶所不具备的功能有________。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体 D.用来加热溶解固体溶质
(3)配制0.2 mol·L-1的Na2CO3溶液480 mL的主要步骤有:①溶解 ②计算 ③转移洗涤 ④定容摇匀 ⑤称量;正确的操作顺序是:_____________________。(填序号)
(4)根据下列操作对所配溶液浓度偏高的有(填序号)____________。
①碳酸钠晶体失去了部分结晶水 ②用“左码右物”的称量方法称量晶体
③碳酸钠晶体不纯,其中混有氯化钠④定容时俯视
⑤容量瓶未经干燥就使用 ⑥定容摇匀后,发现]液面低于刻度线,再加水到刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有12.8g CO和CO2的混合气体,在标准状况下其体积为8.96 L。回答下列问题:
(1)该混合气体的平均摩尔质量为_____________。
(2)混合气体中碳原子的个数为___________(用NA表示阿伏加德罗常数的值)。
(3)将混合气体依次通过如图所示装置,最后收集在气球中(实验在标准状况下测定)。
①气球中收集到的气体为___________其体积为________L。
②被除去气体发生反应的离子方程式为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实与胶体性质无关的是( )
A.在豆浆里加入盐卤做豆腐
B.河流入海处易形成沙洲
C.一束平行光线照射蛋白质溶液时,从侧面可以看到光亮的通路
D.三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂保存或盛放方法正确的是( )
A.浓硝酸盛放在铜质器皿中
B.稀硝酸盛放在铁质器皿中
C.NaOH溶液保存在带橡胶塞的试剂瓶中
D.NaOH溶液保存在带玻璃塞的试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC将117号元素命名为Ts(中文名“石田”,tián),Ts的原子核外最外层电子数是7。下列说法错误的是
A. Ts与F同主族 B. Ts的最外层p轨道中有5个电子
C. 在同族元素中Ts金属性最强 D. 中子数为176的Ts符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应中属于加成反应的是
A.CH4+2O2→CO2+2H2OB.CH2=CH2+H-OH→CH3-CH2OH
C.CH4+Cl2→CH3Cl+HClD.HCl+AgNO3=AgCl↓+HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com