
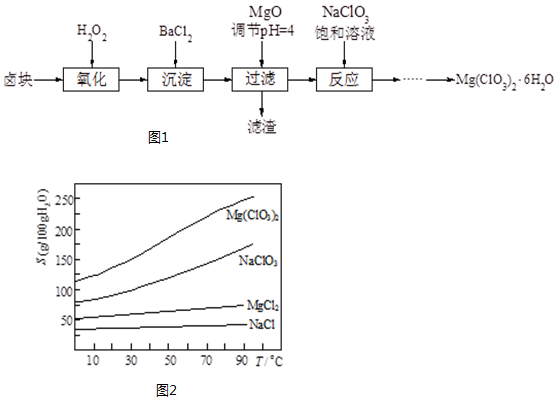
分析 制备Mg(ClO3)2•6H2O的流程卤块:的成分有MgCl2•6H2O、MgSO4、FeCl2,加入H2O2之后,亚铁离子可以被氧化为三价铁离子,再向混合物中加入氯化钡溶液,可以将硫酸根离子转化为硫酸钡沉淀,加入氧化镁,调节pH=4,可以促进铁离子的水解,将铁离子转化为氢氧化铁而除去,过滤,得到的滤液是氯化镁,滤渣有BaSO4和Fe(OH)3,根据溶解度曲线可知,混合溶液中NaCl溶解度最小,再加入NaClO3饱和溶液得到NaCl沉淀与Mg(ClO3)2溶液,经过蒸发浓缩、趁热过滤、冷却结晶、过滤、洗涤、干燥得到Mg(ClO3)2•6H2O,据此分析.
解答 解:(1)加入MgO的作用是调节溶液的pH=4,可以促进铁离子的水解,使杂质Fe3+形成沉淀完全除去,所以加MgO后得到沉淀Fe(OH)3,之前加的氯化钡将硫酸根离子沉淀,过滤的滤渣为BaSO4和Fe(OH)3;
故答案为:BaSO4和Fe(OH)3;
(2)检验硫酸根离子是否除净的方法:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全;
故答案为:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全;
(3)利用NaCl、Mg(ClO3)2的溶解度与温度的关系将溶液蒸发浓缩、趁热过滤、冷却结晶,最后过滤、洗涤,就得到Mg(ClO3)2•6H2O;
故答案为:趁热过滤;冷却结晶;
(4)将产品先用水洗涤,再用无水乙醇清洗.无水乙醇的作用是减少产品的损耗,使产品快速干燥;
故答案为:减少产品的损耗,使产品快速干燥;
(5)氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
(6)带有旋塞、活塞等部件的仪器容量瓶、滴定管使用之前必须查漏,并且滴定前要用标准液润洗滴定管,否则会将标准液稀释,实验计算的剩余亚铁离子的物质的量结果会偏高,则反应掉的会偏小,Mg(ClO3)2•6H2O的含量测定结果偏小;
故答案为:容量瓶、滴定管;小;
(7)根据化学方程式:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3-~6Fe2+,Cr2O72-~6Fe2+,用0.100mol•L-1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100mol•L-1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10-3L×1.000mol•L-1-0.009mol=0.011mol,
氯酸根离子的物质的量为:$\frac{1}{6}$×0.011mol,产品中Mg(ClO3)2•6H2O的质量分数:($\frac{1}{2}$×0.011×299g/mol)×10×$\frac{1}{3.5}$×100%=78.31%;
故答案为:78.31%.
点评 本题考查物质的制备,涉及对常见金属元素及其化合物主要性质的掌握,以及对离子反应实质的认识;同时考查应用基础知识解决简单化学问题的能力以及对图表的观察、分析能力,物质溶解度概念的应用,晶体析出的方法,杂质离子的除杂原则和试剂选择,题目难度中等.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 盐酸、氨水、碱石灰都是混合物 | |
| B. | 将Na单质长时间的放置于空气中,最终得到的白色固体是NaHCO3 | |
| C. | SiO2不能溶于水生成H2Si03,因此SiO2不是酸性氧化物 | |
| D. | 用焰色反应检验Na+之前,应用稀硫酸清洗铁丝,并在火焰上灼烧至无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,颗粒大小相同的锌粒分别与pH值相同的硫酸和盐酸反应 | |
| B. | A+B$\stackrel{500℃}{→}$C;D+E$\stackrel{100℃}{→}$F | |
| C. | 相同温度下,与同浓度盐酸反应的锌粒和铁粉 | |
| D. | G+H→W+Q(Q>0),其他条件相同时分别在200℃和100℃时反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
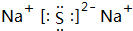 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
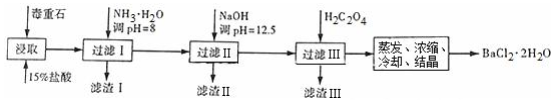
| Ca2+ | Mg2+ | Fe3+ | |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4没有同分异构体 | B. | CH3Cl没有同分异构体 | ||
| C. | CH2Cl2没有同分异构体 | D. | CCl4没有同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=10的CH3COONa溶液中,水电离产生的c(OH-)=1×10-10mol•L-1 | |
| B. | pH=a的氨水溶液,稀释10倍(溶液体积变为原来10倍)后,其pH=b,则a=b+1 | |
| C. | pH=3的H2S溶液与pH=11的NaOH溶液任意比例混合:C(Na+)+c(H+)=c(OH-)+c(HS-) | |
| D. | pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的:c(Na+)大小顺序为 ①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com