
【题目】亚氯酸钠是重要漂白剂,大庆市某高中化学实验探究小组设计如下实验制备亚氯酸钠(NaClO2)晶体。
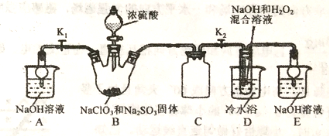
【查阅资料】
I.NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成 NaClO3和NaCl。
II.B中发生的主要反应:2NaClO3+Na2SO3+H2SO4(浓)=2ClO2↑+2Na2SO4+H2O。
【进行实验】
(1)盛装NaClO3和Na2SO3固体的仪器名称是_____。
(2)装置C的作用是____________。
(3)ClO2气体与装置D中混合溶液反应生成NaClO2,生成NaClO2的反应方程式为______。
(4)反应后,经以下步骤可从装置D的溶液获得NaClO2晶体。请补充完整操作。
①55℃蒸发结晶;②趁热过滤;③38-60℃热水洗涤;④低于____干燥,得到成品。
右图是某同学的过滤操作示意图,其操作不规范的是________(填标号)。
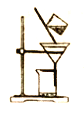
a.将滤纸湿润,使其紧贴漏斗壁
b.滤纸边缘高出漏斗边缘
c.用玻璃棒引流
d.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
【实验反思】
(1)如果撤去D中的冷水浴,可能导致产品中混有的杂质是_______。
(2)实验须使B中NaClO3稍微过量,原因是__________,如NaClO3不足,则装置D中可能产生SO42-,检验装置D中是否含有SO42-的方法是:取少量D中反应后的溶液于试管中,__________,证明溶液中存在SO42-。
(3)测定产品中NaClO2的纯度。测定时进行如下实验:
准确称mg样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液。取25.00mL待测溶液,加入淀粉溶液做指示剂,用cmol·L-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。所称取的样品中NaClO2<span lang="EN-US" style="font-size:10.5pt;mso-bidi-font-size:12.0pt;font-family:"Times New Roman","serif";mso-fareast-font-family:"Times New Roman";mso-ansi-language:EN-US;mso-fareast-language:ZH-CN;mso-bidi-language:AR-SA">质量百分含量</span>为_________(用含m、c、V的代数式表示)。
【答案】 三颈烧瓶 防止D试管中液体进入B中(或安全瓶、防倒吸) 2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O 60℃ b d NaClO3和NaCl NaClO3稍微过量,防止B中产生SO2进入D试管中,影响产品纯度 加入足量的盐酸,无现象,再加适量BaCl2溶液,产生白色沉淀 ![]() %
%
【解析】本题考查实验方案设计与评价,【进行实验】(1)盛放NaClO3和Na2SO3的固体的仪器是三颈烧瓶;(2)装置C的作用是安全瓶,防止D试管中液体进入装置B中;(3)根据信息,ClO2→NaClO2,其中Cl的化合价由+4价→+3价,化合价降低,即ClO2作氧化剂,H2O2作还原剂,被氧化成O2,因此有ClO2+H2O2+NaOH→NaClO2+O2↑+H2O,然后根据化合价的升降发进行配平,即离子方程式为2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O ;(4)根据信息,NaClO2在高于60℃时,分解成NaClO3和NaCl,因此低于60℃干燥;过滤注意事项:一贴二低三靠,a、根据过滤时注意事项,故a说法正确;b、过滤时滤纸的边缘低于漏斗边缘,故b说法错误;c、过滤时用玻璃棒引流,故c说法正确;d、过滤时不能用玻璃棒搅拌,防止弄破滤纸,故d说法正确;【实验反思】(1)如果撤去D中冷水浴,可能造成温度超过60℃,使NaClO2分解成NaClO3和NaCl,因此产品中杂质可能是NaClO3和NaCl;(2)因为硫酸和亚硫酸钠反应生成SO2,SO2进入装置D中,产生杂质,因此NaClO3稍微过量的目的是防止B中产生SO2进入D试管中,影响产品纯度;检验SO42-的操作是:加入足量的盐酸,无现象,再加适量BaCl2溶液,产生白色沉淀;(3)建立关系式:ClO2-~2I2~4S2O32-,因此样品中m(NaClO2)=V×10-3×c×100×90.5/(4×25)g,即质量分数为V×10-3×c×100×90.5/(4×25×m)×100%=![]() %。
%。


科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 验证Fe(NO3)2是否变质 | 将Fe(NO3)2溶于稀硫酸中,再滴加KSCN溶液,观察是否变化 |
B | 制备Fe(OH)3胶体 | 向沸水中滴加饱和FeCl3溶液,加热并搅拌 |
C | 证明氧化性H2O2比Fe3+强 | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
D | 验Ksp(AgI)<Ksp(AgCl) | 向AgCl的悬浊液中滴加KI溶液,出现黄色沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.卤代烃是一类重要的有机合成中间体,是许多有机合成的原料。根据卤代烃的相关性质,回答下列问题
(1)化合物A和B的分子式都是C2H4Br2,A的核磁共振氢谱图如右图所示,则A的结构简式为___________,

请预测B的核磁共振氢谱上应该有__________个峰(信号)。
(2)某同学用如图1装置(铁架台、酒精灯等略)验证取代反应和消去反应的产物。
实验操作Ⅰ:在试管中加入5 mL 1 mol/L NaOH水溶液和0.5 mL溴乙烷振荡。
实验操作Ⅱ:将试管如图1固定后,水浴加热。
①据图1:用水浴加热而不直接用酒精灯加热的原因是_________________。

②图2是为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,
实验中需要检验的产物是_________________________,
水的作用是________________________________________,
实验现象是___________________________________________。
Ⅱ.下图所示为某化学兴趣小组设计的乙醇氧化的实验装置(图中加热装置、铁架台、铁夹等均未画出)。图中:A、无水乙醇(沸点:78.5℃),B、绕成螺旋状的细铜丝或银丝,C、无水硫酸铜粉末,D、碱石灰,E、高锰酸钾,F、蒸馏水

(1)为使A中乙醇平稳转化成乙醇蒸汽,常采用的方法是_________________;
(2)D处碱石灰的作用______________________;
(3)反应后的C处实验现象是: _____________ ;
(4)写出B处发生反应的化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )

A. 溶液中OH-向电极a移动
B. 反应消耗的NH3与O2的物质的量之比为4:3
C. 负极的电极反应式为2NH3-6e-+6OH-=N2+6H2O
D. 电子迁移方向:电极a→导线→电极b→电解质溶液→电极a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用电解法还原CO2是CO2资源化的一种方法。某学习小组设计了一套以CO2为原料制备ZnC2O4的装置,其反应原理示意图如下(电解液不参与电极反应)。下列说法正确的是

A. 电源的正极应与Pb电极连接
B. 电解时Zn2+可通过阳离子交换膜进入左侧
C. 电解时,阴极反应为:Zn-2e-═Zn2+
D. 标况下,消耗CO2气体4.48L时,交换膜右侧电解液质量减轻6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质不属于同分异构体的是( )
A. 2,2﹣二甲基丙醇和2﹣甲基丁醇 B. 甲基丙烯酸和甲酸丙酯
C. 2﹣甲基丁烷和戊烷 D. 邻氯甲苯和对氯甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小块钠投入到FeCl3溶液中,观察到的现象是( )
A. 钠溶解,有铁析出并有气体产生
B. 只有气体产生
C. 既有气体产生,又有红褐色沉淀产生
D. 只有沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷是一种常见燃料,下列有关丙烷的叙述中不正确的是( )
A. 分子中碳原子不在一条直线上 B. 光照下能够发生取代反应
C. 比丁烷更易液化 D. 是石油分馏的一种产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼锡的第一步反应原理为2SnO2+3C===2Sn+aM↑+CO2↑,则下列说法中错误的是( )
A. 反应中SnO2被还原
B. a的值为3
C. 反应后元素化合价升高生成的物质有两种
D. 每生成1 mol CO2转移电子8 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com