
【题目】石灰石是一种化工原料,可以通过反应生成一系列物质,如图::
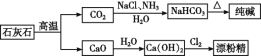
下列说法正确的是( )
A.漂粉精是混合物,主要成分是氯化钙
B.图示的制纯碱方法,要求先向饱和食盐水中通NH3,,然后再通CO2
C.纯碱属于碱,俗名苏打
D.制取纯碱和漂粉精所涉及的反应都是非氧化还原反应
【答案】B
【解析】
A.根据工业流程图判断漂白精的主要成分;
B.NH3极易溶于水且溶液呈弱碱性,再通入CO2使之更多地转化为HCO3;
C.碱是指在电离时产生的阴离子全部是氢氧根离子的化合物;
D.制备漂白精的反应中氯元素的化合价发生变化,属于氧化还原反应。
A.漂白精为氯气和氢氧化钙反应的产物,2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,其主要成分是次氯酸钙和氯化钙,故A错误;
B.NH3极易溶于水且溶液呈弱碱性,再通入CO2使之更多地转化为HCO3,故工业上,可先向饱和食盐水中通入NH3后再通入CO2制NaHCO3,碳酸钠受热分解制取纯碱,故B正确;
C.纯碱是碳酸钠,俗名苏打,是由钠离子和碳酸根离子组成的化合物,属于盐,故C错误;
D.向饱和食盐水中通NH3,然后再通CO2制取碳酸氢钠,加热分解碳酸氢钠制取纯碱,两反应中元素化合价不变化,属于非氧化还原反应,但制备漂白精的反应中氯元素的化合价由0价变化为1、+1价,属于氧化还原反应,故D错误;
故答案选B。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】硫酸是当今世界上最重要的化工产品之一,广泛应用于工业各个方面。硫酸的生产工艺几经改进,目前工业上主要采用接触法制备硫酸。接触室中发生如下反应:2SO2+O2![]() 2SO3。
2SO3。
(1)上述生成SO3的反应属于__________
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
(2)该反应是氧化还原反应,下列说法正确的是__________
A.SO2是氧化剂
B.O2发生氧化反应
C.O2失去电子
D.SO3既是氧化产物又是还原产物
(3)该反应也是放热反应,下列说法不正确的是__________
A.形成SO3中的硫氧键放出能量
B.断开SO2中的硫氧键放出能量
C.反应物的总能量大于生成物的总能量
D.放热反应的逆反应一定是吸热反应
(4)下列关于该反应的说法中,正确的是__________
A.增大接触室内炉气的压强对化学反应速率无影响
B.升高温度能加快反应速率
C.添加催化剂对反应速率无影响
D.增大O2的浓度能使SO2完全转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都为短周期元素,A的核外电子数和周期数相等;B的+1价阳离子和C的―1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题。
(1)B元素在元素周期表中的位置是第___周期___族。
(2)画出D元素的原子结构示意图___,E元素形成的分子的电子式___。
(3)与E的氢化物分子所含电子总数相等的分子是___(举一例、填化学式,下同),离子是___。
(4)A与C形成的化合物中含有化学键的类型是___。
(5)D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物X、Y、Z的分子式都是C7H8O,当它们处于液体状态时,分别滴入到FeCl3溶液,只有Z呈紫色,若投入金属钠,只有Y无现象,下列说法不正确的是( )
A.Z的官能团名称为羟基
B.X属于醇类
C.Y没有同类物质的同分异构体
D.Z的结构简式只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表示下列反应的离子方程式正确的是( )
A.钠与水反应:Na+H2O=Na++OH-+H2↑
B.NaOH溶液与稀硫酸反应:OH-+H+=H2O
C.铁片和稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
D.石灰石与硝酸反应:C![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制含碳、氮、硫的化合物等大气污染物对打造宜居环境具有重要意义。
(1)已知反应![]() 的
的![]() 分子中化学键断裂时分别需要吸收
分子中化学键断裂时分别需要吸收![]() 的能量,则
的能量,则![]() 分子中化学键断裂时需要吸收的能量为______kJ。
分子中化学键断裂时需要吸收的能量为______kJ。
(2)用![]() 消除
消除![]() 污染的反应原理如下:
污染的反应原理如下:![]() ,不同温度条件下,
,不同温度条件下,![]() 与NO的物质的量之比分别为
与NO的物质的量之比分别为![]() 时,得到
时,得到![]() 脱除率曲线如图所示:
脱除率曲线如图所示:
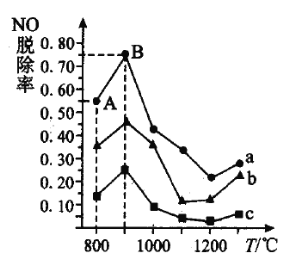
曲线![]() 对应
对应![]() 与
与![]() 的物质的量之比是_______。
的物质的量之比是_______。
②曲线![]() 中
中![]() 的起始浓度为
的起始浓度为![]() ,从
,从![]() 点到
点到![]() 点经过
点经过![]() ,该时间段内
,该时间段内![]() 的脱除速率为_________________
的脱除速率为_________________![]() 。
。
(3)已知常温下电离平衡常数:![]() 的
的![]() 的
的![]() 。
。
①溶液中下列微粒可以大量共存的是___________(填字母)。
a.![]() b.
b.![]() c.
c.![]()
②常温下,某种碳酸钠与碳酸氢钠混合溶液的![]() ,则
,则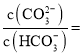 _____________。
_____________。
(4)利用电解法处理高温空气中稀薄的![]() (
(![]() 浓度约为
浓度约为![]() 的10倍),装置示意图如图所示,固体电解质可传导
的10倍),装置示意图如图所示,固体电解质可传导![]() 。
。
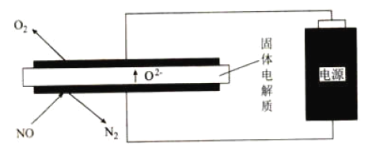
①阴极的电极反应式为_______________。
②消除一定量的![]() 所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)__________。
所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
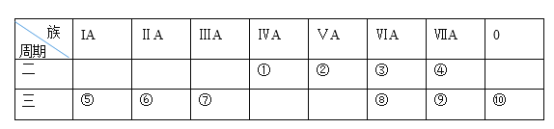
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是________________________。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),
(3)这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(4)⑤、⑧两种元素的最高价氧化物对应的水化物相互反应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种形状像蝴蝶结的有机分子Bowtiediene,其形状和结构如图所示,下列有关该分子的说法中错误的是

A. 生成1 mol C5 H12至少需要4 mol H2
B. 该分子中所有碳原子在同一平面内
C. 三氯代物只有一种
D. 与其互为同分异构体,且只含碳碳三键的链烃有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属硫化物作为一种新兴的具有电化学性能的电极材料,在不同的领域引起了研究者的兴趣,含有过渡金属离子废液的回收再利用有了广阔的前景,下面为S2与溶液中金属离子的沉淀溶解平衡关系图,若向含有等浓度Cu2+、Cd2+、Zn2+、Co2+、Fe2+的废液中加入含硫的沉淀剂,则下列说法错误的是
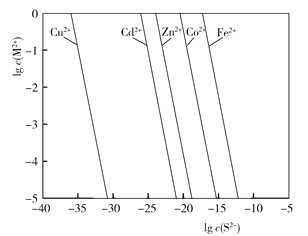
A.由图可知溶液中金属离子沉淀先后顺序为Cu2+、Cd2+、Zn2+、Co2+、Fe2+
B.控制S2浓度可以实现铜离子与其他金属离子的分离
C.因Na2S、ZnS来源广、价格便宜,故常作为沉铜的沉淀剂
D.向ZnS中加入Cu2+的离子方程式为:S2+Cu2+![]() CuS↓
CuS↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com