
反应物X转化为Y和Z的能量变化如图所示。下列说法正确的是
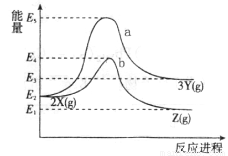
A. X→Y反应的活化能为E5
B. 加入催化剂曲线a变为曲线b
C. 升高温度增大吸热反应的活化能,从而使化学反应速率加快
D. 压缩容器体积不改变活化能,但增大单位体积活化分子数,使得反应速率加快
科目:高中化学 来源:2016-2017学年山西省大同市高一3月月考化学试卷(解析版) 题型:选择题
有X、Y两种元素,原子序数≤20,X的原子序数小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是( )
A. 若X的最高价含氧酸为强酸,则X的氢化物溶于水一定显酸性
B. 若Y的最高正价为+m,则X的最高正价一定为+m
C. 若X元素形成的单质是X2,则Y形成的单质一定是Y2
D. 若X(OH)n为强碱,则Y(OH)n也一定为强碱
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省太原市高一3月阶段性测试化学试卷(解析版) 题型:选择题
甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是

A. 金属性:甲>乙>丁
B. 原子半径:辛>戊>甲
C. 丙与庚的元素原子核外电子数相差13
D. 形成的最简单氢化物的稳定性:己>戊
查看答案和解析>>
科目:高中化学 来源:2017届新疆乌鲁木齐地区高三第二次诊断性测验化学试卷(解析版) 题型:简答题
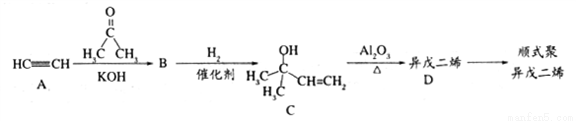
乙炔是一种重要的工业原料,由它制备人造橡胶——顺式聚异戊二烯的一种合成路线如下:
已知:在一定条件下可发生下列反应:
①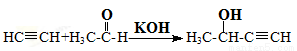 E
E
②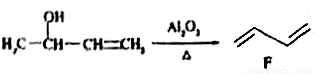
(1)乙醛的核磁共振氢谱中有______种峰,峰面积之比为_______。
(2)题给信息中反应②的反应类型是_____________。
(3)C中含氧官能团的名称是_______,D的系统命名法的名称是______。
(4)D分子中最多______个原子共面。
(5)下列物质能与E发生化学反应的是_______(填编号)。
a.溴水 b.酸性高锰酸钾 c.乙酸
(6)写出A→B的化学方程式_______。
(7)写出D生成顺式聚异戊二烯的化学方程式______________。
(8)写出与A物质具有相同官能团的异戊二烯的三种同分异构体结构简式_______、______、______。
查看答案和解析>>
科目:高中化学 来源:2017届新疆乌鲁木齐地区高三第二次诊断性测验化学试卷(解析版) 题型:选择题
己知:①Mn(s)+O2(g)=MnO2(s)△Hl
②S(s)+O2(g)=SO2(g)△H2
③Mn(s)+S(s)+2O2(g)=MnSO4(s)△H3
则下列表述正确的是
A.△H2>0
B.△H3>△H1
C.Mn+SO2==MnO2+S△H=△H2-△H1
D.MnO2(s)+ SO2(g)==MnSO4(s)△H=△H3-△H2-△H1
查看答案和解析>>
科目:高中化学 来源:2017届新疆乌鲁木齐地区高三第二次诊断性测验化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A. 25℃、l0IKPa下,NA个C18O2分子的质量为48g
B. 标准状况下,22.4L HF中含有的电子数为10NA
C. 1mol白磷(P4)分子中所含化学键的数目为4NA
D. 1L0.1 mol/L的NaClO水溶液中含有的氧原子数为0.l NA
查看答案和解析>>
科目:高中化学 来源:南开中学2016-2017高三第四次月考理综化学试卷 题型:选择题
以铬酸钾(右室起始加入0.4molK2CrO4)为原料,电化学法制备重铬酸钾的实验装置示
意图如下,下列说法正确的是
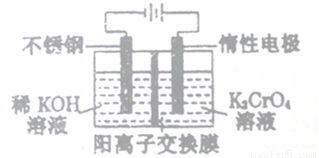
A. 在阳极室,通电后溶液逐渐由橙色变为黄色
B. 电路中有0.2mol电子通过时,阳极与阴极溶液减少的质量差为1.4g
C. 若测得右室中K与Cr的物质的量之比为3:2,则此过程电路中共转移电子数为0.1NA
D. 若测定阳极液中K与Cr的物质的量之比为d,则此时铬酸钾的转化率为2-d
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考试化学试卷(解析版) 题型:选择题
根据元素周期律,由下列事实进行归纳推测,推测不合理的是
选项 | 事实 | 推测 |
A | Mg与水反应缓慢,Ca与水反应较快 | Ba与水反应会更快 |
B | Si是半导体材料,同族的Ge也是半导体材料 | 第ⅣA族的元素的单质都可作半导体材料 |
C | HCl在1 500 ℃时分解,HI在230 ℃时分解 | HBr的分解温度介于二者之间 |
D | Si与H2高温时反应,S与H2加热能反应 | P与H2在高温时能反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届河北省石家庄市高三下学期模拟联考理科综合化学试卷(解析版) 题型:简答题
某工厂用一固体废渣(主要成份为Al2O3·Cr2O3,还含有FeO、SiO2)为主要原料回收利用,生产红矾钠晶体(Na2Cr2O7·2H2O),同时制备明矾(KAl(SO4)2·12H2O)。其主要工艺流程如下:
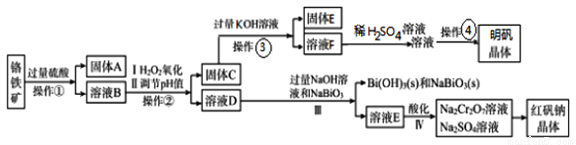
己知:NaBiO3不溶于冷水,在碱性条件下能将Cr3+氧化为CrO42-
(1)I、II目的是___________。
(2)实验室中操作④的名称为_______________。
(3)己知:Ksp[Fe(OH)3]=3.0×10-39,Ksp[Al(OH)3]=3×10-33。当pH=5.6时Cr(OH)3开始沉淀。室温下,II中需调节溶液pH范围为___________(杂质离子浓度小于1×10-6mol/L视为沉淀完全)。
(4)写出Ⅲ中发生反应的离子方程式_____________。
(5)IV中酸化是用硫酸而不用盐酸酸化,理由是_____________(结合化学方程式回答)。
(6)写出溶液F和硫酸溶液反应的离子方程式_________,若用足量二氧化碳通入F中,则生成的溶液中离子浓度关系为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com