
| A. | ETFE的结构中,存在-CF2-CH2-CF2-CH2-连接方式 | |
| B. | 四氟乙烯与乙烯发生缩聚反应得到ETFE | |
| C. | 以乙烯为原料经过加成反应、取代反应可制得乙二醇 | |
| D. | ETFE材料是热固型(体形结构)的塑料 |
分析 A.根据CF2=CF2、CH2=CH2的链节分别为:-CF2-CF2-、-CH2-CH2-;
B.根据加聚反应无小分子生成,缩聚反应有小分子生成;
C.以乙烯为原料经过加成反应取代反应可制得乙二醇;
D.ETFE是由四氟乙烯和乙烯加聚而成,是线型结构.
解答 解:A.ETFE是由四氟乙烯和乙烯加聚而成,其结构中存在-CF2-CF2-CH2-CH2-的连接方式,故A错误;
B.四氟乙烯与乙烯发生反应得到ETFE,无小分子生成,是加聚反应,不是缩聚反应,故B错误;
C.乙烯与溴水发生加成反应得到1,2-二溴乙烷,1,2-二溴乙烷与NaOH水溶液发生取代反应可制得乙二醇,故C正确;
D.ETFE是由四氟乙烯和乙烯加聚而成,是线型结构,属于热塑型塑料,故D错误;
故选C.
点评 本题主要考查了有机物的性质与反应类型,掌握加聚反应的原理是解题的关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 该烃的名称是2-乙基-1-丁烯 | |
| B. | 该烃与H2加成得到的烷烃的名称是3-甲基戊烷 | |
| C. | 该烃可使溴水褪色,但不能与溴发生取代反应 | |
| D. | 该烃与HCl加成得两种卤代烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
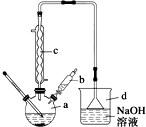 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 它的名称为( )
它的名称为( )| A. | 3,3-二甲基-2-乙基-戊烷 | B. | 3,3-二甲基-4-乙基戊烷 | ||
| C. | 2,3,3-三甲基戊烷 | D. | 3,3,4-三甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com