
| A. | 32g O2所含的原子数目为NA | |
| B. | 0.5mol H2O含有的原子数目为1.5NA | |
| C. | 1mol H2O含有的H2O分子数目为NA | |
| D. | 0.5NA个氧气分子的物质的量是0.5mol |
分析 A.每个氧分子中含2个原子,根据N(O)=2 $\frac{m({O}_{2})}{M({O}_{2})}$NA计算判断;
B.1mol水分子中含2molH原子和1molO原子;
C.1mol H2O含有的H2O分子1mol,n=$\frac{N}{{N}_{A}}$;
D.n=$\frac{N}{{N}_{A}}$计算氧气分子物质的量.
解答 解:A.每个氧分子中含2个原子,N(O)=2$\frac{m({O}_{2})}{M({O}_{2})}$NA=2$\frac{32g}{32g/mol}$NA=2NA,32g O2所含的原子数目为2NA ,故A错误;
B.0.5mol H2O含有的原子数目=0.5mol×3×NA=1.5NA ,故B正确;
C.1mol H2O含有的H2O分子数目=1mol×NA=NA ,故C正确;
D.0.5NA个氧气分子的物质的量=$\frac{0.5{N}_{A}}{{N}_{A}}$=0.5mol,故D正确;
故选A.
点评 本题考查了阿伏伽德罗常数的简单计算,题目难度不大,注意熟练掌握阿伏伽德罗常数与物质的量、摩尔质量之间的转化关系,试题能够培养学生灵活应用所学知识的能力.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:实验题

| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
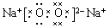
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
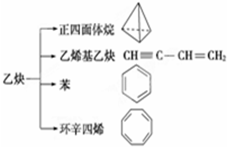 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.下列说法正确的是( )
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.下列说法正确的是( )| A. | 正四面体烷的分子式为C4H4,其二氯代物有两种 | |
| B. | 苯为平面六边形结构,分子中存在C-C和C═C,能使酸性KMnO4溶液褪色 | |
| C. | 等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量相同 | |
| D. | 环辛四烯跟苯的结构很像,不能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a L | B. | $\frac{a}{2}$ L | C. | $\frac{a}{3}$ L | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y和Q可形成化合物Y3Q4 | |
| B. | T和Z各有一种单质的空间构型为正四面体形,键角都是109°28? | |
| C. | X和Q结合生成的化合物可以形成离子化合物 | |
| D. | ZQ2是极性键构成的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定含有离子键,共价化合物中可能含有离子键 | |
| B. | 共价化合物中一定含有共价键,离子化合物中可能含有共价键 | |
| C. | 由非金属元素形成的化合物中一定只含共价键 | |
| D. | 含有金属元素的化合物中一定含有离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com