
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.80 | 21.00 |
| 2 | 20.00 | 1.00 | 20.80 |
| 3 | 20.00 | 0.20 | 22.80 |
| c(标准)?V(标准) |
| c(待测) |
| c(标准)?V(标准) |
| c(待测) |
| c(标准)?V(标准) |
| c(待测) |
| c(标准)?V(标准) |
| c(待测) |
| 20.20mL+19.80mL |
| 2 |
| c(标准)?V(标准) |
| c(待测) |
| 20×10-3L×0.2mol/L |
| 20×10-3L |
| 0.05mol×40g/mol |
| 5g |
| c(标准)?V(标准) |
| c(待测) |


科目:高中化学 来源: 题型:
| A、1.0 L 0.1 mol/L的NH4Cl溶液中NH4+的数目为0.1NA |
| B、常温下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数为0.1NA |
| C、常温下,0.05 mol CO2和SO2混合气体中所含氧原子数为0.1NA |
| D、高温高压下,1.4 g N2与0.3 g H2反应,生成的NH3分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(C)c(D) |
| c(A)c(B) |
| A、①③⑥ | B、①⑤ |
| C、①④⑤ | D、②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ﹙1﹚在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图1.
﹙1﹚在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图1.查看答案和解析>>
科目:高中化学 来源: 题型:
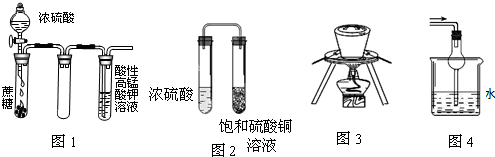
| A、图1酸性KMnO4溶液中没有气泡出现,但溶液颜色会逐渐变浅乃至褪去 |
| B、图2久置后,饱和硫酸铜溶液可能析出蓝色晶体 |
| C、图3在海带提碘实验中用于灼烧海带 |
| D、图4可用于吸收易溶于水的尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
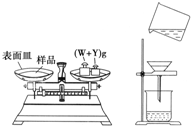
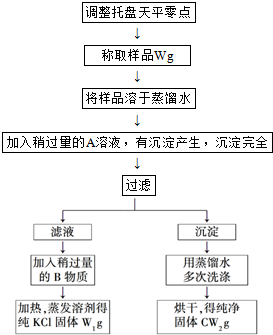
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
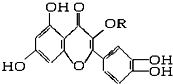
| A、可与溴水反应,且1 mol该物质与足量溴水反应耗6 mol Br2 |
| B、可与NaOH溶液反应,1 mol该物质可与4 mol NaOH反应 |
| C、一定条件下1 mol该物质可与H2加成,耗H2最大量为7 mol |
| D、维生素P遇FeCl3溶液发生显色反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com