
����Ŀ������ѧ�����ʽṹ������������ͼ��Ԫ�����ڱ���һ���֡���֪R�ĺ˵����С��36����̬�⻯��е㣺MHn>YHn��
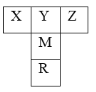
��1����������Ԫ�ص�һ������������ ����Ԫ�ط��ţ���Y������⻯����ӵĿռ乹��Ϊ ����̬Rԭ������ ��δ�ɶԵ��ӡ�
��2��Y������������۵��M������������۵�ͣ�ԭ���� ��YZ�����Ҽ���м���������Ϊ ��
��3��YO32����Yԭ�ӵ��ӻ���ʽ�� ��д��һ����YO32����Ϊ�ȵ����������� ���û�ѧ���ű�ʾ����
��4��Z��һ�ֳ����⻯����������ͭ��Ӧ�����������ýṹ��ʽ��ʾ��������е������ӣ� ��
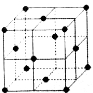
��5����ͼΪij�������ʵ��������������ṹʾ��ͼ���þ�������λ���� ����ô˾�����ܶ�Ϊ2.7g.cm��3�������ı߳�Ϊ0.405nm����˽���ԭ�ӵ����ԭ������Ϊ �����������������
���𰸡���1��N��1�֣��������壨1�֣�2��1�֣�
��2��Y������������Ƿ��Ӿ���,M�������������ԭ�Ӿ��� 1�U2��2�֣�
��3��sp2��2�֣� NO3-����SO32- ��SiO32-��BF3������1�֣�
��4�� 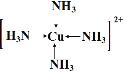 ����С���߲��۷֣���2�֣���5��12��1�֣� 27��2�֣�
����С���߲��۷֣���2�֣���5��12��1�֣� 27��2�֣�
��������
���������R�ĺ˵����С��36����Ԫ�������ڱ������λ�ã���֪X��Y��Z���ڵڶ����ڣ�M���ڵ������ڣ�R���ڵ������ڣ���̬�⻯��е㣺MHn��YHn���⻯��YHn����֮��û�������HԪ����AlԪ��֮�䲻���γ���̬�⻯���YΪCԪ�ء�MΪSi��RΪGe��XΪB��ZΪNԪ�ء�
��1��ͬ�������϶��µ�һ�����ܼ�С��ͬ������ԭ����������Ԫ�ص�һ����������Ԫ��2p�ܼ�Ϊ�����ȶ�״̬����һ�����ܸ���ͬ��������Ԫ�صģ���������Ԫ�ص�һ������������NԪ�أ�Y������⻯��ΪCH4�����ӵĿռ乹��Ϊ�������塣��̬Rԭ����Χ�����Ų�ʽΪ4s24p2�� 2��δ�ɶԵ��ӣ�
��2��Y�����������Ϊ���Ӿ��壬M�����������Ϊԭ�Ӿ��壬��Y������������۵��M������������۵�ͣ�CN-�뵪�����ӻ�Ϊ�ȵ����壬CN-��Cԭ����Nԭ��֮���γ�3�Թ��õ��Ӷԣ�����������������Ŀ��Ϊ1��2��
��3��CO32-��Cԭ�ӹµ��Ӷ���=(4+22��3)/2=0���۲���Ӷ���=3+0=3��Cԭ�ӵ��ӻ���ʽ��sp2��һ����CO32-��Ϊ�ȵ����������Ϊ NO3-����SO32-��SiO32-��BF3������
��4��Z��һ�ֳ����⻯����������ͭ��Ӧ����������������е�������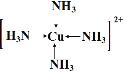 ��
��
��5���Զ���ԭ���о�����֮���ڵ�ԭ�Ӵ������ģ�ÿ������Ϊ8���������ã�ÿ������Ϊ2���������ã��þ�������λ����3��8/2=12��������ԭ����ĿΪ8��1/8+6��1/2 =4������������ԭ������ΪM����4��M/6.02��1023g=2.7g/cm3����0.405��10-7cm��3�����M=27.



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ױƷ�����Z��������Ч��ԭ����������ȡ���ֿ������·�Ӧ�Ʊ���

������������ȷ����
A. X��Z������Na2CO3��Һ��Ӧ�ų�CO2
B. X��Y��Z����ʹ��ˮ��ɫ
C. Y���ܷ���ȡ����Ӧ��Ҳ�ܷ����ӳɷ�Ӧ
D. Y�����Ӿ۷�Ӧ���壬X�������۷�Ӧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ����ʵ�ó��Ľ�����ȷ���ǣ� ��
A. ��SiO2������ˮ��Ӧ����H2SiO3����֪SiO2����H2SiO3������
B. ��SiO2+2C![]() Si+2CO������֪̼�ķǽ����Դ��ڹ�
Si+2CO������֪̼�ķǽ����Դ��ڹ�
C. CO2ͨ��Na2SiO3��Һ������ɫ��������֪����H2CO3��H2SiO3
D. SiO2����NaOH��Һ��Ӧ��Ҳ��������ᷴӦ����֪SiO2Ϊ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������������˵����ȷ����
A. �����ֱ����Դͨ���ý��壬��������ɫ�����˵���ý���������
B. ����FeCl3��Һ��Fe��OH��3���壬���ö����ЧӦ��۲���ɫ���ַ���
C. ���ù��ˣ��ɽ�Fe��OH��3�����е�FeCl3���ʳ�ȥ
D. ��Fe(OH)3�����м������������Һ�����������۳�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȱ�ʾ����ʵ����ǿ��������ȵĶ��壺
�������ѵ���ĵ���ʷ���������Һ��ԭ�е���ʵ��ܷ���������100%��
��֪25��ʱ���������������ĵ��������ҺŨ�Ⱦ�Ϊ0.1 mol��L��1�����±���
��� | ���������� | ����Ȧ� |
A | ������Һ����һ����ȫ���������ڶ���HSO4- | 10% |
B | ����������Һ��HSO4- | 29% |
C | ���CH3COOH | 1.33% |
D | ���HCl��H����Cl�� | 100% |
��1��25��ʱ��0.1 mol��L��1����������Һ�У�c��H������С�����˳���� �����������
��2��25��ʱ��0.1 mol��L��1������Һ��HSO4-�ĵ����С����ͬ�¶���0.1 mol��L��1����������Һ��HSO4-�ĵ���ȣ���ԭ���� ��
��3������ĵ���ƽ�ⳣ��K�ı���ʽ�� ������ĵ���ƽ�ⳣ��K�����Ȧ��Ĺ�ϵʽΪ��K= ���ú����Ĵ���ʽ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС�������һ��ʵ����֤Ԫ�������ɡ�
����Ϊ����ʵ��ķ�����֤þ�����Ľ�����ǿ����ѧ����ѧ���ҷֱ���������ֲ�ͬ�ķ�����
����һ��ѧ������ˮ���Լ����Ƚ�þ������ˮ��Ӧ�����
��������ѧ������ϡ�������Լ����Ƚ�þ������ϡ���ᷴӦ�����
�ش��������⣺
��1��ѧ������ʵ����ȡ��һ�κ�ɫ��þ����Ͷ��ϡ�����У�����ʮ�����ԣ������ԭ��_______________________��
��2��ѧ���������辶������þ�����ĵ��ʣ�����þ�����Ŀ����μ�һЩ������ѧ�Լ�������ʵ��Ҳ�ó���ȷ�Ľ��ۣ�����ѧ�����õ���ʲô������____________________��
����ѧ�����������ͼװ������֤����̼����Ԫ�صķǽ�����ǿ��������Ƶ�ʵ���ֱ��֤�������������ǿ������֪A��ǿ�ᣬ�����¿���ͭ��Ӧ��B�Dz�����ˮ�Ŀ�״���壻��Һ©���Ļ�����C�пɹ۲쵽��ɫ�������ɡ�
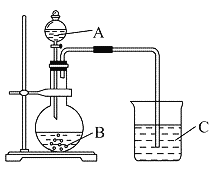
��1��д����ѡ�����ʵĻ�ѧʽ�� B��_______________��
��2��д���ձ��з�����Ӧ�����ӷ���ʽ��_______________��
��3����ʵ���кβ���֮��?______________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڱ���˵����ȷ����
A. �ܷ���ȡ����Ӧ B. �ܶȱ�ˮ��
C. �����д��ڵ�˫������ṹ D. ����ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У�����ȱ��ֳ�ǿ�����ԣ��ֱ��ֳ����Ե��ǣ� ��
A.ϡ������п����Ӧ��������
B.Ũ����ʹ�������ۻ�
C.Ũ������ͭ��Ӧ���ȷ�Ӧ����SO2
D.Ũ�����ľ̿�ڼ��������·�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ѧϰС����ճ������в���ȱ�ٵĵ�ζƷM����̽������֪C����D��ȼ�շ�����ɫ���森M���������ʵ�ת����ϵ��ͼ��ʾ�����ֲ�������ȥ����
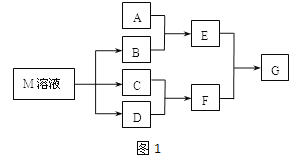
��1��д��F�ĵ���ʽ ��
��2����A��һ�ֳ���������������ҿ��������첣����E��Һ��F��Һ��Ӧ�����Ʊ�һ�ֽ��壬��E��Һ���׳���___________
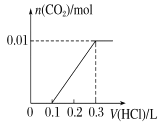
��3����A��CO2���壬A��B��Һ�ܹ���Ӧ����Ӧ�����õ���Һ�������ᷴӦ����ͼ��ʾ����A��B��Һ��Ӧ����Һ�е����ʻ�ѧʽΪ ��
��4����A��һ�ֳ����������ʣ���A��B��Һ�ܹ���Ӧ��������F��Һ��μ���E��Һ���ӱ�����������ʵ�������� ��
��5����A��һ�ֻ��ʣ�ʵ���ҿ���A��B��Ӧ��ȡ����E��E��F��E��D������ð���̣�������E ��D�ķ�Ӧ��������D�Ĺܵ��Ƿ�й¶��д��E��D��Ӧ�Ļ�ѧ����ʽ�� ��
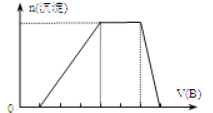
��6����A��һ����Һ��ֻ���ܺ���H+��NH4+��Mg2+��Fe3+��Al3+��CO32����SO42���е�ijЩ���ӣ��������Һ�м���B��Һʱ�������ɳ��������ʵ�����B��Һ����������仯��ͼ.��ʾ���ɴ˿�֪������Һ�п϶����е����Ӽ���Ũ��֮��Ϊ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com