
通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行,使化学反应有利于人类的生存和提高生活质量。下列各图所示的措施中,能加快化学反应速率的是( )
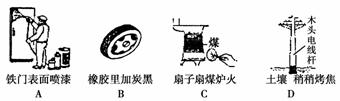
科目:高中化学 来源: 题型:
海水中含有丰富的锂资源,研究人员开发了一种只能让锂离子通过的特殊交换膜,并运用电解实现从海水中提取高浓度的锂盐,其工作原理如右图所示。
下列说法不正确的是( )
A.a连接电源的正极
B.Li+的移动方向是从海水进入到盐酸中
C.一段时间后,b电极附近溶液的pH降低
D.电解过程中还可能获得有经济价值的副产物氢气和氯气
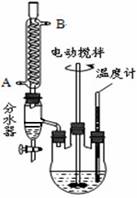
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释事实的方程式不准确的是
A.用浓盐酸检验氨:NH3 + HCl == NH4Cl B.碳酸钠溶液显碱性:CO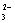 + H2O ≒ HCO
+ H2O ≒ HCO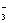 + OH
+ OH
C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe–3 e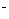 == Fe
== Fe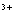
D.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2 +CO2 == CaCO3↓+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A.麦芽糖及其水解产物均能发生银镜反应
B.用溴水即可鉴别苯酚溶液、2,4–己二烯和甲苯
C.在酸性条件下,CH3CO OC2H5的水解产物是CH3CO
OC2H5的水解产物是CH3CO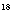 OH和C2H5OH
OH和C2H5OH
D.用甘氨酸(H2NCH2COOH)和丙氨酸(CH3CHNH2COOH)缩合最多可形成4种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成:
①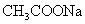 与
与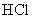 ;②
;②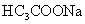 与NaOH
与NaOH
③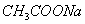 与
与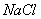 ④
④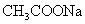 与
与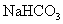 下列各项排序正确的是( )
下列各项排序正确的是( )
A.pH:②>③>④>① B 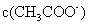 :②>④>③>①
:②>④>③>①
C.溶液中:①>③>②>④ D 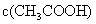 :①>④>③>②
:①>④>③>②
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+3B(g) 2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是( )
2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是( )
A.v(D)=0.4 mol·L-1·s-1
B.v(C)=0.5 mol·L-1·s-1
C.v(B)=0.6 mol·L-1·s-1
D.v(A)=0.15 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究小组利用丙酮的溴代反应(CH3COCH3+Br2CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
| 实验序号 | 初始浓度c/mol·L-1 | 溴颜色消失所需时间t/s | ||
| CH3COCH3 | HCl | Br2 | ||
| ① | 0.80 | 0.20 | 0.0010 | 290 |
| ② | 1.60 | 0.20 | 0.0010 | 145 |
| ③ | 0.80 | 0.40 | 0.0010 | 145 |
| ④ | 0.80 | 0.20 | 0.0020 | 580 |
分析实验数据所得出的结论不正确的是( )
A.增大c(CH3COCH3),v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大c(HCl),v(Br2)增大
D.增大c(Br2),v(Br2)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
分别将下列物质:①FeCl3②CaO③NaCl④Ca(HCO3)2⑤Na2SO3⑥K2SO4投入水中,在蒸发皿中对其溶液加热蒸干,能得到原物质的是( )
A.②③ B.③⑥ C.①④ D.⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
Ⅰ.已知H2A在水中存在以下平衡:H2AH++HA-,HA-H++A2-。
(1)相同浓度下,NaHA溶液的pH________(填“大于”、“小于”或“等于”) Na2A溶液的pH。
(2)某温度下,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1 mol/L KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是________。
a.c(H+)·c(OH-)=1×10-14
b.c(Na+)+c(K+)=c(HA-)+2c(A2-)
c.c(Na+)>c(K+)
d.c(Na+)+c(K+)=0.05 mol/L
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:
CaA(s)Ca2+(aq)+A2-(aq) ΔH>0。
①降低温度时,Ksp________(填“增大”“减小”或“不变”)。
②滴加少量浓盐酸,c(Ca2+)________(填“增大”“减小”或“不变”)。
Ⅱ.含有Cr2O 的废水毒性较大,某工厂废水中含5.00×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.00×10-3 mol·L-1的Cr2O 。为使废水能达标排放,作如下处理:Cr2O
。为使废水能达标排放,作如下处理:Cr2O
 Cr3+、Fe3+石灰水,Cr(OH)3、Fe(OH)3
Cr3+、Fe3+石灰水,Cr(OH)3、Fe(OH)3
(1)该废水中加入绿矾(FeSO4·7H2O)和稀硫酸,发生反应的离子方程式为
________________________________________________________________________。
(2)欲使10 L该废水中的Cr2O 完全转化为Cr3+,理论上需要加入________g FeSO4·7H2O。
完全转化为Cr3+,理论上需要加入________g FeSO4·7H2O。
(3)若处理后的废水中残留的c(Fe3+)=2×10-13 mol·L-1,则残留的Cr3+的浓度为________。(已知:
Ksp=4.0×10-38 Ksp=6.0×10-31)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com