
| A. | 某烷烃命名为2,3,4-三甲基-3,5-二乙基己烷 | |
| B. | 结构片段为 的高聚物,是其单体通过缩聚反应生成 的高聚物,是其单体通过缩聚反应生成 | |
| C. | 所有的糖、油脂、蛋白质都能水解,但水解产物不同 | |
| D. | 醋酸和硬脂酸互为同系物,C2H6和C9H20也一定互为同系物 |
分析 A.主链含6个C,则5号C上不能有乙基,主链选错;
B.根据该高聚物的主链全部为C可知,该高聚物是通过加聚反应生成的高分子化合物;
C.单糖不能水解;
D.结构相似,分子组成上相差1个或者若干个CH2基团的化合物互称为同系物.
解答 解:A.主链含6个C,则5号C上不能有乙基,主链选错,名称应为2,3,4,5-四甲基-3-乙基庚烷,故A错误;
B.根据该高分子化合物的结构片段可知,主链只含有碳原子,该高分子化合物是通过加聚反应生成的,故B错误;
C.单糖中不能水解,比如葡萄糖和果糖,故C错误;
D.醋酸与硬脂酸互为同系物,而C2H6和C9H20都符合烷烃同系物的通式,也一定互为同系物,故D正确;
故选D.
点评 本题考查较为综合,涉及有机物的结构、性质以等,为高频考点,侧重于学生的分析能力的考查,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:解答题
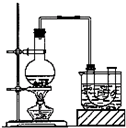 已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.
已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
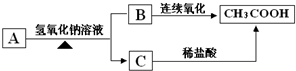
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
| A. | 放电时,电极A为负极 | |
| B. | 根据上表数据,请你判断该电池工作的适宜温度应控制在350℃~2050℃ | |
| C. | 放电时,Na+的移动方向为从电极A到电极B | |
| D. | 充电时,总反应为Na2Sx═2Na+xS(3<x<5),则阳极的电极反应式为Sx2--2e-═xS |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
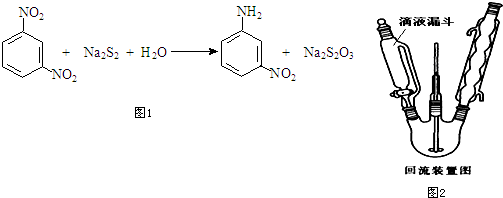
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
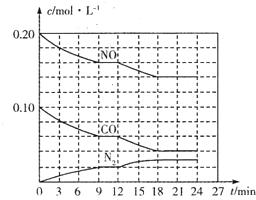 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com