
常温度下,将Cl2缓慢通入水中至饱和,然后再滴加0.1mol/L的NaOH溶液,整个过程中 溶液的pH变化曲线如图所示。下列选项正确的是

A. a点所示的溶液中
B. b点所示的溶液中
C. c点所示的溶液中
D. d点所示的溶液中
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
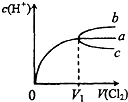 (2010?和平区一模)一定温度下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如图中曲线a.已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( )
(2010?和平区一模)一定温度下,将Cl2缓慢通入水中.当通入的Cl2体积为V1时达到饱和,溶液中c(H+)变化如图中曲线a.已知Cl2的溶解度随温度升高而迅速降低,下列叙述中正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
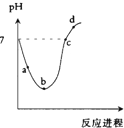 常温度下,将Cl2缓慢通入水中至饱和,然后再滴加0.1mol/L的NaOH溶液,整个过程中溶液的pH变化曲线如图所示.下列选项正确的是( )
常温度下,将Cl2缓慢通入水中至饱和,然后再滴加0.1mol/L的NaOH溶液,整个过程中溶液的pH变化曲线如图所示.下列选项正确的是( )| A、a点所示的溶液中c(H+)=c(Cl-)+c(HCl0)+c(OH-) | B、b点所示的溶液中c(H+)>c(Cl-)>c(HClO)>c(ClO-) | C、c点所示的溶液中c(Na+)=c(HCl0)+c(ClO-) | D、d点所示的溶液中c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温度下,将Cl2缓慢通入水中至饱和,然后再滴加0.1mol/L的NaOH溶液,整个过程中 溶液的pH变化曲线如图所示。下列选项正确的是
A. a点所示的溶液中 C(H+)=c(Cl-)+c(HClO)+c(OH-)
B. b点所示的溶液中 C(H+)﹥c(Cl-)﹥ c(HClO) ﹥ c(ClO-)
C. c点所示的溶液中 C(Na+)=c(HClO) + c(ClO-)
D. d点所示的溶液中 C(Na+)﹥c(ClO-)﹥ c(Cl-)﹥c(HClO)

查看答案和解析>>
科目:高中化学 来源:2012届浙江省杭州十四中高三5月模拟测试理科综合化学试卷(带解析) 题型:单选题
常温度下,将Cl2缓慢通入水中至饱和,然后再滴加0.1mol/L的NaOH溶液,整个过程中溶液的pH变化曲线如图所示。下列选项正确的是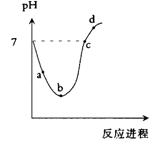
A.a点所示的溶液中 |
B.b点所示的溶液中 |
C.c点所示的溶液中 |
D.d点所示的溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com