
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如图所示:已知:①SO2(g)+Cl2(g)SO2Cl2(l)+Q(Q>0)
②硫酰氯常温下为无色液体,熔点为﹣54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气.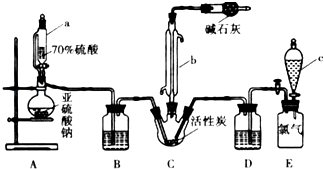
(1)仪器a为恒压分液漏斗,与普通分液漏斗相比,其优点是 .
(2)装置C中干燥管里碱石灰作用是 . 装置E为储气装置,用于提供氯气,当装置E中排出氯气1.12L(已折算成标准状况)时,最终得到5.4g纯净的硫酰氯,则硫酰氯的产率为 . 为提高硫酰氯的产率,本实验操作中还需要注意的事项有
(3)反应结束后,将C装置中三颈烧瓶里的混合物分开的实验操作是 , 氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式
(4)若将SO2、Cl2按照一定比例通入水中,请设计简单实验验证二者是否恰好完全反应. .
【答案】
(1)平衡分液漏斗内外气压,便于液体顺利流下
(2)防止空气中水进入;80%;控制气体流速,宜慢不宜快或对三颈烧瓶进行适当的降温等
(3)过滤;2ClSO3H=SO2Cl2+H2SO4
(4)检验其漂白性
【解析】解:(1)仪器a为恒压分液漏斗,可以平衡分液漏斗内外气压,便于液体顺利流下,所以答案是:平衡分液漏斗内外气压,便于液体顺利流下;(2)装置C中产生硫酰氯,硫酰氯在潮湿空气中“发烟”,所以要用碱石灰防止空气中的水分进入装置C,氯气的物质的量为 ![]() =0.05mol,由方程式可知n(SO2Cl2)=n(Cl2)=0.05mol,故理论上生成SO2Cl2的质量为0.05mol×135g/mol=6.75g,故其产率为
=0.05mol,由方程式可知n(SO2Cl2)=n(Cl2)=0.05mol,故理论上生成SO2Cl2的质量为0.05mol×135g/mol=6.75g,故其产率为 ![]() ×100%=80%;为提高本实验中硫酰氯的产率,可以控制气体流速,宜慢不宜快,使其充分反应,由于100℃以上SO2Cl2开始分解,该反应为放热反应,可以对三颈烧瓶进行适当的降温,所以答案是:防止空气中水进入;80%;控制气体流速,宜慢不宜快或对三颈烧瓶进行适当的降温等;(3)反应结束后,装置C中有活性炭和硫酰氯,硫酰氯常温下为无色液体,可以用过滤的方法分离它们,氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质应为H2SO4 , 反应的化学方程式为2ClSO3H=SO2Cl2+H2SO4 , 所以答案是:过滤;2ClSO3H=SO2Cl2+H2SO4;(4)若将SO2、Cl2按照一定比例通入水中,如果恰好完全反应,则生成氯化氢和硫酸,无论有谁过量,溶液都会有漂白性,所以验证二者是否恰好完全反应的方法是检验其漂白性, 所以答案是:检验其漂白性.
×100%=80%;为提高本实验中硫酰氯的产率,可以控制气体流速,宜慢不宜快,使其充分反应,由于100℃以上SO2Cl2开始分解,该反应为放热反应,可以对三颈烧瓶进行适当的降温,所以答案是:防止空气中水进入;80%;控制气体流速,宜慢不宜快或对三颈烧瓶进行适当的降温等;(3)反应结束后,装置C中有活性炭和硫酰氯,硫酰氯常温下为无色液体,可以用过滤的方法分离它们,氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质应为H2SO4 , 反应的化学方程式为2ClSO3H=SO2Cl2+H2SO4 , 所以答案是:过滤;2ClSO3H=SO2Cl2+H2SO4;(4)若将SO2、Cl2按照一定比例通入水中,如果恰好完全反应,则生成氯化氢和硫酸,无论有谁过量,溶液都会有漂白性,所以验证二者是否恰好完全反应的方法是检验其漂白性, 所以答案是:检验其漂白性.


科目:高中化学 来源: 题型:
【题目】下列每组中各有三对混合物,它们都能用分液漏斗分离的是( )
A. 煤油和水,酒精和水,醋酸和水B. 植物油和水,四氯化碳和水,苯和水
C. 酒精和水,汽油和水,汽油和酒精D. 苯和水,四氯化碳和苯,醋酸和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将H2、O2、N2三种气体分别装在三个相同容器里,当温度和密度相同时,三种气体压强的大小关系正确的是( )
A. p(H2)=p(O2)=p(N2)B. p(H2)> p(N2)>p(O2)
C. p(O2)> p(N2) > p(H2)D. p(O2)>p(H2)>p(N2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究A的组成与结构,某同学进行了如下实验:
实 验 步 骤 | 实 验 结 论 |
(i)将9.0g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过足量的浓硫酸和碱石灰,发现两者分别增重5.4g和13.2g. | (i)A的实验式为 . |
(ii)通过质谱法测得其相对分子质量为90. | (ii)A的分子式为 |
(iii)另取9.0g A,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况). | (iii)A中含有的官能团名称为 . |
(iv)A的核磁共振氢谱有四组吸收峰,其峰面积之比为2:2:1:1. | (iv)综上所述,A的结构简式为 . |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列物质在水溶液中的电离方程式
(1)氯化镁_________________________ (2)硫酸氢钠_____________________
(3)碳酸氢钠 _____________________ (4)硫酸铝______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“水煤气(CO、H2)﹣空气”燃料电池的工作原理如图所示,其中a、b均
为惰性电极.下列叙述正确的是( )
A.甲处通入的是空气,乙处通入的是水煤气
B.a电极发生还原反应,b电极发生氧化反应
C.用该电池电镀铜,若待镀金属增重6.4g,至少消耗标准状况下的水煤气2.24L
D.a电极的反应式包括:CO+4OH﹣+2e﹣═CO32﹣+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.氯气溶于水:Cl2+H2O=2H++Cl﹣+ClO﹣
B.Na2CO3溶液中CO ![]() 的水解:CO
的水解:CO ![]() +H2O=HCO
+H2O=HCO ![]() +OH﹣
+OH﹣
C.酸性溶液中KIO3与KI反应生成I2:IO3﹣+I﹣+6H+=I2+3H2O
D.NaHCO3溶液中加足量Ba(OH)2溶液:HCO ![]() +Ba2++OH﹣=BaCO3↓+H2O
+Ba2++OH﹣=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH、Cl-、Mg2+、Ba2+、CO![]() 、SO
、SO![]() ,现取三份各100 mL溶液分别进行如下实验:
,现取三份各100 mL溶液分别进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g.根据上述实验,以下推测正确的是
A. K+一定存在 B. 100 mL溶液中含0.01 mol CO![]()
C. Cl-一定存在 D. Ba2+一定不存在,Mg2+可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等.
(1)以N2 和H2 为原料合成氢气的反应为:N2(g)+3H2(g)2NH3(g)△H=QkJ.mol﹣1 . 已知N﹣N 键键能为946kJ.mol﹣1 , H﹣H键键能为436kJ.mol ﹣1 , N﹣H键键能为391kJ.mol﹣1 , 则Q= .
(2)将体积均为560mL(标准状况下)的SO2 和Cl2 同时缓慢通水中,得到1.0L溶液,则溶液pH= .
(3)物质的量浓度相等的NH4HSO3溶液和NaHSO3溶液中,阴离子的电离程度较小的是(填化学式),原因是
(4)用惰性电极电解NaHSO3 溶液的装置如图所示,则I是(填化学式,下同),阳极区放出的混合气体的成分为 . 
(5)氨水是一种常见的沉淀剂.向1.0L2.0×10﹣4mol.L﹣1的MgCl2 溶液中通入 (不考虑溶液体积的变化),有白色沉淀生成.
①写出生成白色沉淀的离子方程式
②当反应中开始有白色沉淀出现时,通人的体积(标准状况)为 mL.(已知实验条件下NH3 . H2O的电离平衡常数为1.8×l0﹣5 , Ksp[Mg(OH)2]=1.8×10﹣11)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com