
| A. | 在氧化还原反应中,失去电子的物质所含元素化合价降低 | |
| B. | 在一个氧化还原反应中,氧化剂和还原剂不可能是同一物质 | |
| C. | 氧化还原反应的本质是电子的转移(得失或偏移) | |
| D. | 在氧化还原反应中所有元素的化合价一定都发生变化 |
分析 A、失电子化合价升高;
B、氯气与氢氧化钠反应生成氯化钠和次氯酸钠,氯气既是氧化剂又是还原剂;
C、化学反应中,当有电子得失或偏移时,发生氧化还原反应,为氧化还原反应的实质;
D、氧化还原反应中可能部分元素的化合价变化.
解答 解:A、失电子化合价升高,而不是降低,故A错误;
B、氯气与氢氧化钠反应生成氯化钠和次氯酸钠,氯气既是氧化剂又是还原剂,所以在一个氧化还原反应中,氧化剂和还原剂可能是同一物质,故B错误;
C、化学反应中,当有电子得失或偏移时,发生氧化还原反应,为氧化还原反应的实质,故C正确;
D、氧化还原反应中可能部分元素的化合价变化,如氯气与水的反应中只有Cl元素的化合价变化,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意结合实例解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②③ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K=$\frac{[C]•[{H}_{2}O]}{[CO]•[{H}_{2}]}$ | B. | K=$\frac{[CO]•[{H}_{2}]}{[C]•[{H}_{2}O]}$ | C. | K=$\frac{[CO]•[{H}_{2}]}{[{H}_{2}O]}$ | D. | K=$\frac{[{H}_{2}O]}{[CO]•[{H}_{2}]}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z元素的最高价氧化物对应的水化物酸性强于Y元素的最高价氧化物对应的水化物 | |
| B. | X、Y、Z形成的简单离子的半径大小:Yn->Zm->Xm- | |
| C. | 元素Z、Y分别与元素W形成的化合物的热稳定性:WmZ<WnY | |
| D. | 若HnY溶液的酸性比HmZ溶液的酸性强,则Y的非金属性比Z的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{\;}^{16}$O2与${\;}_{\;}^{18}$O2是氧元素的两种核素 | |
| B. | 标准状况下,1.12L${\;}_{\;}^{16}$O2和1.12L${\;}_{\;}^{18}$O2均含有0.1NA个氧原子 | |
| C. | 通过化学变化可以实现${\;}_{\;}^{16}$O与${\;}_{\;}^{18}$O之间的相互转化 | |
| D. | ${\;}_{\;}^{16}$O与${\;}_{\;}^{18}$O核外电子排布方式不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构及性质 |
| A | A的原子半径最小 |
| B | B原子最外层电子数是次外层的两倍 |
| C | C元素在空气中含量最多 |
| D | D是短周期中金属性最强的元素 |
| E | E的最高价氧化物对应水化物是一种常见的两性氢氧化物 |
| R | R与B同主族 |
| T | T的负一价阴离子的核外电子排布与Ar原子相同 |
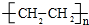 .
. ;它可用于潜艇或呼吸面具的供氧剂,它与H2O反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
;它可用于潜艇或呼吸面具的供氧剂,它与H2O反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③①⑤⑥②④ | B. | ③①②⑥④⑤ | C. | ③⑤①⑥④② | D. | ③⑤①⑥②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | V(A)=$\frac{1}{3}$V(C) | B. | V(B)=$\frac{4}{3}$V(A) | C. | V(C)=4V(B) | D. | V(D)=2V(C) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com