
【题目】
①过滤②蒸发③溶解④向容量瓶中转移液体
A. ①和② B. ①和③ C. ③和④ D. ①和④
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.聚氯乙烯塑料不可用来包装食品
B.缺碘易患大脖子病
C.由于淀粉在人体中会转化为氨基酸,因此每天都要摄入一定量的淀粉
D.皮肤被烫伤或受浓硝酸腐蚀时,细胞结构将受到破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关说法错误的是( )
A. 淀粉和蛋白质都属于天然高分子化合物 B. 医用酒精中乙醇的浓度(体积分数)为75%
C. 用灼烧的方法可以区分蚕丝和人造纤维 D. 水可以用来分离溴苯和苯的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以黄铜矿(主要成分CuFeS2)为原料制备CuSO4·5H2O的主要流程如下:
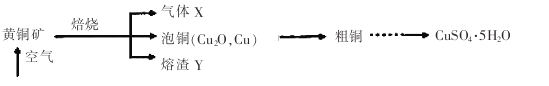
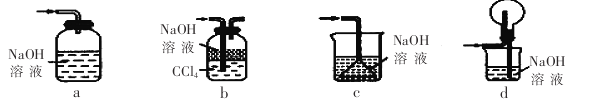
(1)下列装置不能用于吸收气体X的是_____________(填代号)。
(2)熔渣Y的成分为Fe2O3和FeO,选用提供的试剂,设计实验验证熔渣中含有FeO。写出有关实验操作、现象与结论。
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMn04溶液、NaOH溶液、氯水。 。
(3)向粗铜中加入硫酸和硝酸的混酸溶液制取硫酸铜时(杂质不参加反应),混酸中HNO3与H2SO4的最佳物质的量之比为
(4)用滴定法测定所得产品中CuSO4.5H2O的含量,称取ag样品配成100 mL溶液,取出20.00 mL,用c mol.L-l滴定剂EDTA( H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂bmL。滴定反应如下:Cu2++ H2Y2-= CuY2-+ 2H+,则CuSO4·5H2O质量分数为_____________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏 。(填“偏高”、“偏低”和“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同状况下,20mL气体A2和10mL气体B2恰好化合生成20mL气体C,则C的化学式为
A. AB B. AB2
C. A2B D. A4B2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于研究物质性质的基本程序,排列顺序正确是( )
a、观察物质的外观b、实验和观察c、解释及结论d、预测物质的性质.
A.bacd
B.adbc
C.abcd
D.dabc
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品.用图中的实验装置进行实验,证明过氧化钠可作供氧剂.
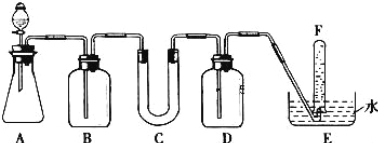
(1)A是利用盐酸和石灰石制取CO2的装置,A中发生反应的化学方程式为 .
(2)填写表中空格:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和NaHCO3溶液 | |
C | ||
D | NaOH溶液 |
(3)写出过氧化钠与二氧化碳反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O、Br2。
(1)已知KBrO3在反应中得到电子,则该反应的氧化产物是________。
(2)0.2 mol KBrO3在反应中得到_____________ mol电子生成 Br2。
(3)根据上述反应可推知________。
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3> Br2 d.还原性:Br2>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的化学计量数填入下列方框中,并标出电子转移的方向和数目(用单线桥法):![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁在现代生产和生活中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水氯化铁并对产物做了如下探究实验。

经查阅资料得知:①无水氯化铁在空气中易潮解,加热易升华;②工业上,向500—600℃的铁屑中通入氯气可生产无水氯化铁;③向炽热铁屑中通入氯化氢可以生产无水氯化亚铁和氢气。
请回答下列问题:
(1)装置的连接顺序为_______________(用a、b、c…h表示)。
(2)若缺少装置E对本实验造成的影响是________________________。
(3)工业生产中,会将D中干燥剂换成无水氯化钙,通过D后产生的过量氯气再用氯化亚铁溶液吸收,得到氯化铁溶液作为副产品。氯化亚铁溶液因吸收C12失去作用而失效,下列试剂中能够检验氯化亚铁溶液是否完全失效的是_______________。
a.硫氰酸钾溶液 b.铁氰化钾溶液 c.高锰酸钾溶液 d.烧碱溶液
(4)实验结束并冷却后,将硬质玻璃管及收集器中的物质一并快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

淡红色溶液中加入过量H2O2后溶液红色加深的原因是___________________(用离子方程式表示)。
已知红色褪去的同时有气体生成,经检验为O2。该小组对红色褪去的原因进行探究。

根据实验现象判断,以下说法正确的是_________________________。(填标号)
a.实验I说明是SCN发生了反应而不是Fe3+发生反应
b.实验I说明是Fe3+发生了反应而不是SCN-发生反应
c.实验I中第3份溶液中生成的白色沉淀为BaSO3
d.实验Ⅱ排除H2O2分解产生的O2氧化SCN-的可能
由实验I和Ⅱ得出结论为_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com