
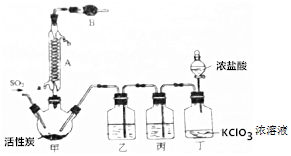
分析 二氧化硫和氯气合成硫酰氯:甲装置:SO2(g)+Cl2(g)$\frac{\underline{\;活性炭\;}}{\;}$SO2Cl2;硫酰氯会水解,仪器B中盛放的药品是碱石灰防止空气中的水蒸气进入装置,同时吸收挥发出去的二氧化硫和氯气,丁装置:浓盐酸和氯酸钾反应制取氯气,浓盐酸易挥发,制取的氯气中含有氯化氢,丙装置:除去Cl2中的HCl,乙装置:干燥氯气,对甲中的混合物蒸馏可得到产品,据此分析.
解答 解:(1)仪器A为球形冷凝管,故答案为:球形冷凝管;
(2)硫酰氯会水解,仪器B中盛放的药品是碱石灰防止空气中的水蒸气进入装置,同时吸收挥发出去的二氧化硫和氯气,故答案为:碱石灰;
(3)丁装置为浓盐酸和氯酸钾反应制取氯气的装置,发生的离子方程式为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O,故答案为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O;
(4)盐酸易挥发,制取的氯气中含有氯化氢,氯气难溶于饱和食盐水;HCl易溶于水,而氯气难溶于饱和食盐水,可用饱和NaCl溶液除去Cl2中的少量HCl,所以丙装置作用为除去Cl2中的HCl;
故答案为:除去Cl2中的HCl;
(5)SO2Cl2遇水生成硫酸和氯化氢,则其水解方程式为:SO2Cl2+2H2O═H2SO4+2HCl,故答案为:SO2Cl2+2H2O═H2SO4+2HCl;
(6)①二者为互溶液体,沸点相差较大,采取蒸馏法进行分离,蒸馏需要使用的玻璃仪器是酒精灯、接液管、锥形瓶和蒸馏烧瓶、温度计、冷凝管;
故答案为:蒸馏;蒸馏烧瓶;温度计;冷凝管;
②氯磺酸(ClSO3H)分解:2ClSO3H$\frac{\underline{\;\;△\;\;}}{\;}$H2SO4+SO2Cl2,取产物在干燥条件下加热至完全反应(或挥发或分解等),冷却后加水稀释;取少量溶液滴加紫色石蕊试液变红,证明溶液呈酸性,再取少量溶液,加入BaCl2溶液产生白色沉淀,说明含有H2SO4,或取反应后的产物直接加BaCl2溶液,有白色沉淀,证明含有硫酸根离子,再滴加紫色石蕊试液变红,说明含有H2SO4;
故答案为:取产物在干燥条件下加热至完全反应(或挥发或分解等),冷却后加水稀释;取少量溶液滴加紫色石蕊试液变红;再取少量溶液,加入BaCl2溶液产生白色沉淀,说明含有H2SO4.或取反应后的产物直接加BCl2溶液,有白色沉淀,再滴加紫色石蕊试液变红,说明含有H2SO4.
点评 本题考查实验制备方案,涉及对反应原理、装置及操作的分析评价、对仪器的识别、物质的分离提纯等,注意对物质性质信息的应用,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 单质硅可用作光导纤维 | |
| B. | 普通玻璃、陶瓷、水泥属于传统无机非金属材料 | |
| C. | 石英晶体是一种空间立体网状结构的晶体,熔点高,硬度大 | |
| D. | 水玻璃可用于制备硅胶和木材防火剂的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 恒温条件下向水中加入少量Na2SO4固体 | |
| B. | 将水加热煮沸 | |
| C. | 恒温条件下向水中通入SO2气体 | |
| D. | 恒温条件下向水中通入氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
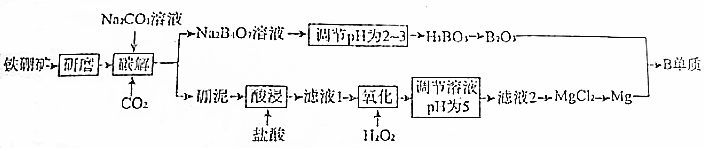
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
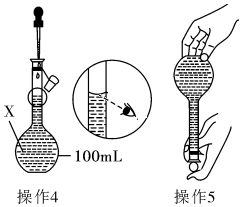 某同学欲配制100mL 0.10mol•L-1的CuSO4溶液.以下操作1~5是其配制的过程及示意图:
某同学欲配制100mL 0.10mol•L-1的CuSO4溶液.以下操作1~5是其配制的过程及示意图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①中,负极上消耗1 mol甲醛时转移2 mol电子 | |
| B. | ①溶液中的H+由正极移向负极 | |
| C. | 理论上消耗的甲醛与生成的Fe2+的物质的量之比为1:4 | |
| D. | ④中,甲醛浓度越大,吸光度越小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com