
 食盐是日常生活必需品,也是重要的化工原料.
食盐是日常生活必需品,也是重要的化工原料.分析 (1)把杂质转化为沉淀或气体除去,除钙离子用碳酸根,除镁离子用氢氧根,除硫酸根用钡离子.要注意除杂质的顺序,后加的试剂最好能把前面先加是过量试剂除掉;
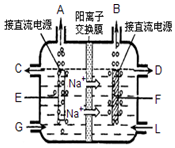
(2)①工业电解饱和食盐水,依据图装置分析,钠离子移向F极,说明F为阴极,E电极为阳极析出的是氯气,F电极析出的是氢气;
②将直流电源的正负极与电极接反,E极为阴极,F为阳极;
(3)氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;每生成1mol氢气生成1mol氯气和2mol氢氧根离子,1mol氯气和2mol氢氧根离子反应生成1mol次氯酸钠.
解答 解:(1)除去粗盐中的可溶性杂质:Mg2+、Ca2+、SO42-时,可以加入过量NaOH(去除镁离子和铁离子):Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓;加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3,碳酸钠必须加在氯化钡之后,氢氧化钠和氯化钡可以颠倒加入的顺序,
故答案为:d c a(或d a c或c d a);
(2)①工业电解饱和食盐水,依据图装置分析,钠离子移向F极,说明F为阴极,E电极为阳极析出的是氯气,F电极析出的是氢气,G处进口的物质是精制的饱和食盐水,离子方程式为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-,
故答案为:阴极;精制的饱和食盐水;2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH-;
②E极为阴极,F为阳极,在阳极上活泼金属失电子,铁失电子生成二价铁离子,在阴极上氢离子得电子生成氢气,氢氧根浓度增大,生成氢氧化铁,氢氧化铁易被氧化,
故答案为:溶液中产生白色沉淀,随后沉淀变为灰绿色,甚至变为红褐色,碳钢网电极被腐蚀;
(3)制取消毒液的离子反应方程式为:2OH-+Cl2=Cl-+ClO-+H2O(或Cl-+H2O$\frac{\underline{\;电解\;}}{\;}$ClO-+H2↑),根据反应可知收集到标况下22.4L即1molH2时可同时生成1mol氯气,1mol氯气和2mol氢氧根离子反应生成1mol次氯酸钠,则生成次氯酸钠的质量为:1mol×74.5g/mol=74.5g,
故答案为:2OH-+Cl2=Cl-+ClO-+H2O(或Cl-+H2O$\frac{\underline{\;电解\;}}{\;}$ClO-+H2↑);74.5g.
点评 本题考查粗盐提纯、电解原理,题目难度不大,明确实验原理为解答关键,注意掌握电解原理内容及应用方法,试题培养了学生的分析能力及综合应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 增加c(CO),平衡向正向移动,反应的平衡常数增大 | |
| B. | 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃ | |
| C. | 第二阶段,Ni(CO)4分解率较低 | |
| D. | 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
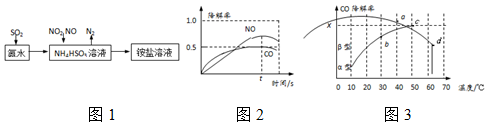
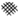 ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围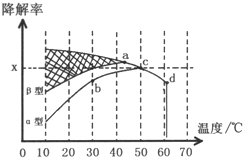 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应N2 (g)+3H2 (g)?2NH3 (g)的△H<0,△S>0 | |
| B. | 地下钢铁管道用导线连接锌块可以减缓管道的腐蚀 | |
| C. | 常温下,Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+ )≤5.6×10-4 mol•L-1 | |
| D. | 常温常压下,锌与稀H2SO4反应生成11.2 L H2,反应中转移的电子数为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
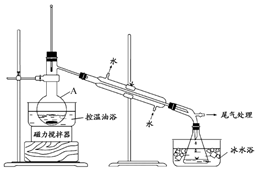 1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g•cm-3.实验室制备少量1-溴丙烷的主要步骤如下:
1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g•cm-3.实验室制备少量1-溴丙烷的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl的反应 | B. | NaOH溶液与盐酸的反应 | ||
| C. | 甲烷与氧气的反应 | D. | 石灰石的分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |
| Z | W |
| A. | 最高正化合价:X=W>Y>Z | |
| B. | 原子半径:W>Z>Y>X | |
| C. | 最高价氧化物对应水化物的酸性:Z<X<W<Y | |
| D. | 最高价含氧酸的钠盐溶液能与SO2反应的:X、Y、Z、W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com