
【题目】某原电池总反应的离子方程式是Fe+2Fe3+=3Fe2+ , 该原电池的组成正确的是( )
Zn | A | B | C | D |
正极 | Fe | C(石墨) | Ag | Zn |
负极 | Cu | Fe | Fe | Fe |
电解质溶液 | FeCl3 | Fe2 (SO4)3 | H2SO4 | FeCl3 |
A.A
B.B
C.C
D.D
科目:高中化学 来源: 题型:
【题目】(1)溶液中,c(H+)=10-x mol·L-1,c(OH-)=10-y mol·L-1,x与y的关系如图所示。
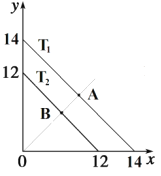
①若从A点到B点,可采取的措施为_________。
②T2 ℃时,将pH=0的NaHSO4溶液逐滴滴加到pH=2 的醋酸溶液中,则水电离出的c(OH-)将______(填“增大”、“减小”、“不变”)。
③已知:T1 ℃时, 醋酸的电离常数为 1.8×10-5,则 T1 ℃时, 在 0.5 mol·L-1的醋酸溶液中由醋酸电离出的 c(H+)约是水电离出的 c(H+)的__________ 倍。
④T2 ℃时,将某溶液(此溶液满足 lg [c(H+)/c(OH-)]=10)滴入含 Na+、 HS-、 SO42-、 K+的溶液中,发生反应的离子方程式为___________。
(2)体积均为1 mL pH=2的一元酸HA和HB,加水稀释过程中pH与溶液体积关系如图所示:
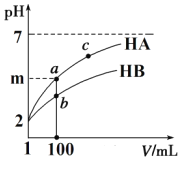
①m的取值为______________。
②a点酸的浓度____________b点酸的浓度(填 “>”、“<”、“=”)。
③若 m<4,常温下a点到c点的过程中,下列表达式的数据变大的是_____________。
A.c(A-) B. n(H+)· n(OH-) C. c(H+)/c(A-) D. c(A-)/[c(HA)· c(OH-)]
(3)已知:25 ℃时,HCN、H2CO3 的电离平衡常数分别为K=4.9×10-10,K1=4.3×10-7、K2=5.6×10-11,向NaCN溶液中通入少量CO2,所发生反应的离子方程式为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度ρg/ml,质量分数为W,物质的量浓度为c mol/L,则下列关系中不正确的是( )
A.ρ=(17V+22400)/(22.4+22.4V) B.W=17c/(1000ρ)
C.W=17V/(17V+22400) D.C=1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:① ②
②![]()
现用丙二酸等物质合成含有小环的有机物K,合成路线如下:
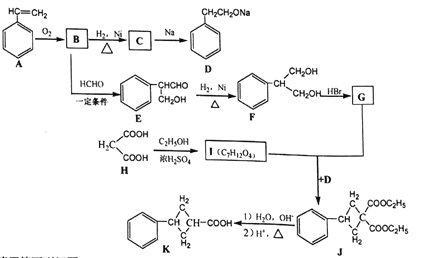
请回答下列问题:
(1)A的名称是_______,E中含氧官能团的名称是_____。
(2)B→C 的反应类型是_______ ,F→G的反应类型是____。
(3)G和I的结构简式分别为_______、________。
(4)写出F和H在一定条件下合成高分子化合物的化学反应方程式:_______。
(5)同时满足下列条件的E的同分异构体数目为________种。
① 能发生银镜反应;② 能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应。
(6)请写出以H2C=CHCH2Br为原料制备![]() ,参考本题题干写出制备的合成线路流程图(无机试剂任选)。________
,参考本题题干写出制备的合成线路流程图(无机试剂任选)。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修:物质结构与性质】
金属钛(22Ti)号称航空材料。回答下列问题:
(1)钛元素基态原子未成对电子数为________个,能量最高的电子占据的能级符号为___________,该能级所在能层具有的原子轨道数为_____________。
(2)[Ti(OH)2(H2O)4]2+中的化学键有_____________。
a.σ键 b.π键 c.离子键 d.配位键
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图所示。

化合物甲的分子中采取sp2杂化方式的碳原子个数为__________,化合物乙中采取sp3杂化的原子的第一电离能由小到大的顺序为____________。
(4)工业上制金属钛采用金属还原四氯化钛。先将TiO2(或天然的金红石)和足量炭粉混合加热至1000~1100K,进行氯化处理,生成TiCl4.写出生成TiCl4的化学反应方程式:_______________。
(5)有一种氮化钛晶体的晶胞如图所示,该晶体的化学式为____________,该晶体中Ti原子周围与距离最近且相等的 N原子的个数为___________。已知晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则晶胞边长为________cm(用含ρ、NA的式子表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:

已知:主反应:2Na2CO3(aq) + 3H2O2(aq)![]() 2Na2CO3·3H2O2(s) ΔH < 0
2Na2CO3·3H2O2(s) ΔH < 0
副反应:2H2O2= 2H2O + O2↑;50℃时2Na2CO3·3H2O2(s) 开始分解。

请回答下列问题:
(1)步骤①的关键是 ,原因是 。
(2)在滤液X中加入适量NaCl固体目的是_________________。
(3)步骤③中选用无水乙醇洗涤产品的目的是 。
(4)下列物质中,会引起过碳酸钠失效的有 。
A.NaHCO3 | B.Na2SO3 | C.Na2SiO3 | D.HCl |
(5)过碳酸钠产品中往往含有少量碳酸钠,可用重量法测定过碳酸钠的质量分数;其操作步骤:取样品溶解→加入BaCl2溶液→过滤→洗涤→干燥→称量。需要直接测定的物理量有: (用字母表示并注明其含义)。产品中过碳酸钠质量分数的表达式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx会引起光化学烟雾等环境问题,在催化剂存在条件下,以NH3或尿素将尾气中NOx
还原为N2的技术,即NH3或尿素-SCR技术,是去除NOx最为有效且应用最广的技术之一,其中最重要的催化剂体系是钒基催化剂。
(1)NH3去除尾气中的NOx,当v(NO):v(NO2)=l:1时称为“快速SCR 反应”,该反应化学方程式为___________。
(2)不同钒含量的催化剂(V2O5/TiO2)添加WO3对NO去除率的影响如下图,从图中可以得出其它条件相同时添加WO3,对NO去除率的影响是_____(填“增大”、“减小”或“无影响”)。根据图中所示,随着温度升高NO去除率的变化趋势为_____,该变化趋势的一种可能原因是___________。

(3)在制备钒基催化剂时,添加的各种成型助剂中碱金属或碱土金属(如Na、K、Ca)能够使催化剂中毒(催化性能下降), K、Ca的毒化作用与Na相似。下列适合做成型助剂有_____。
A.Li B.Mg C.酸性铝溶胶 D.酸性硅溶胶
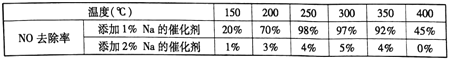
请设计实验研究添加金属K对催化剂活性的影响(只需写出实验思路,不需要具体实验
操作)_____________。
(4)在NOx催化去除过程中,NH3储罐存在危险性,更多应用为尿素-SCR技术。在该技术过程中,发生如下两个反应:
① CO(NH2)2=NH3+HNCO
② HNCO(g)+H20(g)====NH3(g)+CO2(g)
在此过程中一分子尿素可以生成两分子NH3,因此尿素被视为是NH3的有效储存源。反应②的平衡常数表达式为_______。目前商用的尿素溶液浓度为32.5%(密度为1.05g/mL),常称为“Ad Blue ”。1L该商用尿素溶液发生“快速SCR反应”, 理论上最多可消除NO和NO2在标准状况下的体积为______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别按下图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题:
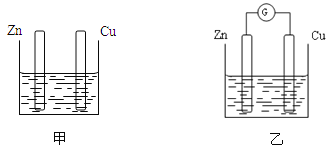
(1)以下叙述中,正确的是 。
A.甲中锌片是负极,乙中铜片是正极 B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液的pH均增大 D.产生气泡的速率甲中比乙中慢
E.乙的外电路中电流方向Zn→Cu
(2)变化过程中能量转化的形式主要是:甲为 ,乙为 。
(3)在乙实验中,某同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了少量气体,分析其原因可能是 。
(4)在乙实验中,如果把硫酸换成硫酸铜溶液,请写出铜电极的电极反应方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com