
分析 (1)平衡常数K350℃<K300℃,说明温度升高时平衡逆向移动,△H-T△S<0时,反应能够自发进行;
(2)A、扩大容器体积,平衡逆向移动,但各组分浓度都减小;
B、恒温恒容下,再充入2molNO2和1molO2,相当于加压,平衡正向移动;
C、容器体积不变,气体质量不变;
D、正反应放热,降温平衡正向移动;
(3)①部分电离的电解质是弱电解质,如果亚硝酸部分电离则亚硝酸是弱电解质,可以根据酸溶液或钠盐溶液的pH判断;
②常温下甲酸铵的水溶液pH<7,说明甲酸根离子的水解程度小于铵根离子的水解程度;
③甲酸铵中含有醛基,能够被银氨溶液氧化;
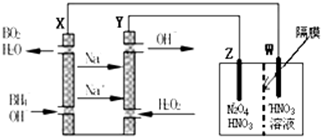
(4)根据钠离子移动方向,判断加入过氧化氢的一极为原电池的正极,发生还原反应,通入BH4-的一极为原电池的负极,发生氧化反应.
解答 解:(1)温度升高时平衡逆向移动,说明正反应放热;该反应的正反应放热,则逆反应吸热,△H>0,若逆反应能够自发进行,则其,△H-T△S<0,必须要△S>0,故答案为:放热;逆反应方向的△S>0;
(2)A、扩大容器体积,无论平衡怎样移动,各组分浓度都减小,混合气体颜色变浅,故A错误;
B、与开始加入比例相同加入反应物,平衡正向移动,反应物转化率增大,故B正确;
C、容器中气体密度始终不变,所以密度不变不能说明反应达到平衡状态,故C错误;
D、降温平衡正向移动,化学平衡常数增大,故D正确;
故答案为:BD;
(3)①A、亚硝酸钠溶液的pH>7,说明亚硝酸钠是强碱弱酸盐,其溶液呈碱性,所以能证明亚硝酸是弱酸,故A正确;
B、亚硝酸能与氢氧化钠发生中和反应只能说明亚硝酸具有酸性,不能说明亚硝酸的电离程度,所以不能证明亚硝酸是弱酸,故B错误;
C、用亚硝酸钠溶液作导电实验,灯泡很暗,不能说明亚硝酸的电离程度,所以不能证明亚硝酸是弱酸,故C错误;
D、常温下,将pH=3的亚硝酸溶液稀释10倍,pH<4,说明稀释亚硝酸时,其氢离子物质的量增大,存在电离平衡,故D正确;
故答案为:AD;
②常温下甲酸铵的水溶液pH<7,说明甲酸根离子的水解程度小于铵根离子的水解程度,离子浓度由大到小的顺序为c(HCOO-)>c(NH4+)>c(H+)>c (OH-),
故答案为:c(HCOO-)>c(NH4+)>c(H+)>c (OH-);
③甲酸铵中含有醛基,能够被银氨溶液氧化,反应的化学方程式为HCOONH4+2[Ag(NH3)2]OH$\stackrel{水浴加热}{→}$(NH4)2CO3+2Ag↓+3NH3+H2O,
故答案为:HCOONH4+2[Ag(NH3)2]OH$\stackrel{水浴加热}{→}$(NH4)2CO3+2Ag↓+3NH3+H2O;
(4)根据钠离子移动方向,判断加入过氧化氢的一极为原电池的正极,发生还原反应,通入BH4-的一极为原电池的负极,发生氧化反应,电极反应式为:BH4-+8OH--8e-=BO2-+6H2O,故答案为:BH4-+8OH--8e-=BO2-+6H2O.
点评 本题考查了反应自发进行的条件、化学平衡的移动、盐类水解以及离子浓度大小比较,考查范围广,难度较大.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:解答题
 .
.  .
.  、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浓盐酸与二氧化锰共热制氯气 | |
| B. | 标准状况下,将1 g铝片投入20 mL 18 mol•L-1硫酸中 | |
| C. | 向100 mL 4 mol•L-1硝酸中加入5.6 g 铁 | |
| D. | 在5×107 Pa、500℃和铁触媒催化的条件下,用氮气和氢气合成氨 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
分子式为C4H8Cl2的同分异构体有( )
A.3种 B.5种 C.8种 D.9种
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等.
氨、硫、氯及其化合物对环境有着重要的影响,在化工生产和日常生活中的用途也十分广泛,如用做漂白剂、沉淀剂、农药、化肥等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 将1.00mol•L-1 NaOH溶液滴入20.00mL 1.00mol•L-1的一元酸HA溶液中,测得混合溶液的pH和温度随加入NaOH溶液体积变化曲线如图所示.下列说法正确的是( )
将1.00mol•L-1 NaOH溶液滴入20.00mL 1.00mol•L-1的一元酸HA溶液中,测得混合溶液的pH和温度随加入NaOH溶液体积变化曲线如图所示.下列说法正确的是( )| A. | 室温时,HA的电离度约为10-6 | |
| B. | 图中B点时,溶液的KW略大于1×10-14 | |
| C. | 图中C点时,溶液中c(A-)=c(Na+)>c(H+)=c(OH-) | |
| D. | 图中D点后,溶液温度略下降的主要原因是生成的 NaA水解吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水鉴别二氧化碳和二氧化硫 | |
| B. | 用KSCN溶液鉴别FeCl2和Fe2(SO4)3 | |
| C. | 用冷却热饱和溶液的方法鉴别NaCl溶液和KNO3溶液 | |
| D. | 用燃着的木条鉴别N2,H2和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氟是电负性最大的非金属元素,又因其半径较小,极易和金属元素反应,并将它们氧化到最高价态,生成MnF7、VF5、CaF2等.氟还可以和氧形成一系列的氟化物,如OF2、O2F2、O4F2等.请回答下列问题:
氟是电负性最大的非金属元素,又因其半径较小,极易和金属元素反应,并将它们氧化到最高价态,生成MnF7、VF5、CaF2等.氟还可以和氧形成一系列的氟化物,如OF2、O2F2、O4F2等.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com