
| A. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 | |
| B. | 三者的单质放置在空气中均只生成氧化物 | |
| C. | 工业上,三者的单质目前都使用热还原法制得 | |
| D. | 电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
分析 A.均为盐酸盐,加热促进水解生成的HCl易挥发;
B.Cu在空中中最终可生成铜绿;
C.Al为活泼金属,利用电解法冶炼;
D.电解AlCl3、FeCl3、CuCl2的混合溶液时,铝离子、铁离子不放电.
解答 解:A.由于AlCl3、FeCl3、CuCl2均是强酸弱碱盐,在溶液中会发生水解反应,若直接加热溶液,水解产生的HCl挥发,是最后得到的固体是金属氢氧化物,因此不能采用将溶液直接蒸干的方法制备,故A正确;
B.Al、Fe、的单质放置在空气中均只生成氧化物,而Cu则发生反应产生盐--铜绿,故C错误;
C.由于Al活动性很强,在工业上采用电解的方法制取,而Fe、Cu在工业上可以使用热还原法制得,故C错误;
D.电解AlCl3、FeCl3、CuCl2的混合溶液时,由于放电能力Cu2+>H+>Fe2+>Al3+,所以阴极上依次析出Cu、H2,而不能产生Fe、Al,故D错误;
故选A.
点评 本题考查Al、Fe、Cu等金属元素的物质的制取、性质及冶炼方法的知识,综合性较强,把握金属及化合物的性质、反应原理为解答的关键,侧重分析与应用能力的考查,注意盐类水解、电解原理的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在食用盐中滴加少量淀粉溶液,探究食用盐是否含有IO3- | |
| B. | 新制氯水显酸性,将其滴加到紫色石蕊溶液中,充分振荡后溶液最终为无色 | |
| C. | 氯气具有漂白性,可以将湿润的有色布条漂白为无色物质 | |
| D. | 根据较强酸可以制取较弱酸的规律,结合酸性的强弱顺序H2CO3>HClO>HCO3-,可以推出少量的CO2通入NaClO溶液中能生成HClO和碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
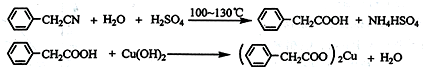
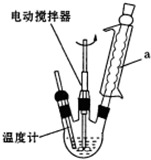
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
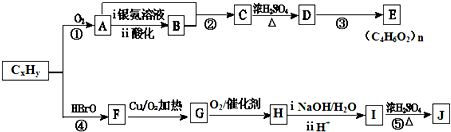


 +2H2O.
+2H2O.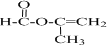 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
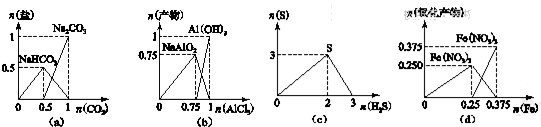
| A. | 图(a):n(NaOH)═1 mol时,CO2和NaOH溶液反应生成的盐 | |
| B. | 图(b):n(NaOH)═3 mol时,AlCl3溶液和NaOH 溶液反应的产物 | |
| C. | 图(c):n(H2S)+n(SO2)═3 mol时,H2S与SO2反应生成的S | |
| D. | 图(d):n(HNO3)═1 mol时,Fe和稀HNO3反应生成的氧化产物(还原产物为NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
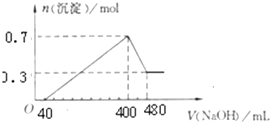 将一定质量的Mg和Al混合物投入400mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系;如图所示.计算:
将一定质量的Mg和Al混合物投入400mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系;如图所示.计算:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com