
| A、(1)(3)(5) |
| B、(1)(3)(5)(6) |
| C、(1)(2)(3)(5(6) |
| D、全部 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定是一种物质被氧化,另一种物质被还原 |
| B、物质在变化中失去电子,此物质是氧化剂 |
| C、发生电子转移的反应一定是氧化还原反应 |
| D、发生化合价升降的反应不一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、F2+H2O (生成F2和HF) |
| B、Na+H2O |
| C、NaH+H2O(生成H2和NaOH) |
| D、Na2O2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
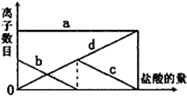 向一定的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是( )
向一定的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中离子数目也相应地发生变化.如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是( )| A、a:Cl-; b:K+; c:CO32-; d:HCO3- |
| B、a:K+; b:CO32-; c:Cl-; d:HCO3- |
| C、a:K+; b:CO32-; c:HCO3-; d:Cl- |
| D、a:K+; b:HCO3-;c:Cl-; d:CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
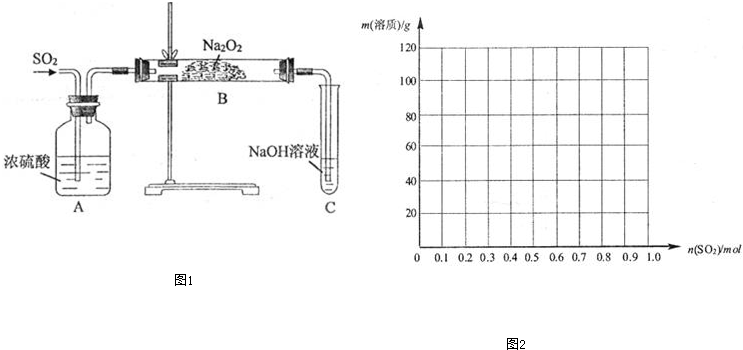
| n(SO2)的范围 | 1mol溶液中溶质的化学式 |
| (0,0.5) | |
| Na2SO3、NaHSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸氢钙溶液中加入足量的苛性钠溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | ||||
B、电解饱和食盐水:2Cl-+2H2O
| ||||
| C、氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-=3Cl-+ClO-+H2O | ||||
| D、FeBr2溶液中通入足量的Cl2:2Fe2++Cl2=2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com